网址:http://m.1010jiajiao.com/timu3_id_87908[举报]
某小型化工厂生产皓矾(ZnSO4·7H2O)结晶前的酸性饱和溶液中含有少量的Cu2+、Fe3+和Fe2+等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程:
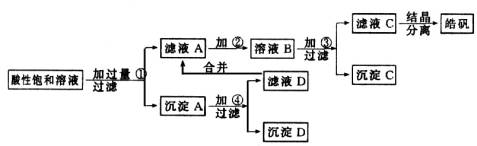
已知开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3为2.7~3.7;Fe(OH)2为7.6~9.6;Zn(OH)2为5.7~8.0。试回答下列有关问题:
(1)加入的试剂①应是________;主要反应的离子方程式有________。
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、浓HNO3等应选用________,其理由是________。
(3)加入试剂③的目的是________。
查看习题详情和答案>>
某小型化工厂生产皓矾(ZnSO4·7H2O)结晶前的酸性饱和溶液中含有少量的Cu2+、Fe3+和Fe2+等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程:
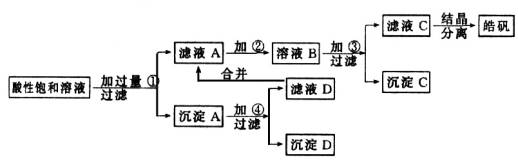
已知开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3为2.7~3.7;Fe(OH)2为7.6~9.6;Zn(OH)2为5.7~8.0。试回答下列有关问题:
(1)加入的试剂①应是________;主要反应的离子方程式有__ _____ _ 。
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、浓HNO3等应选用________,其理由是____ ____。
(3)加入试剂③的目的是______ __。
查看习题详情和答案>>
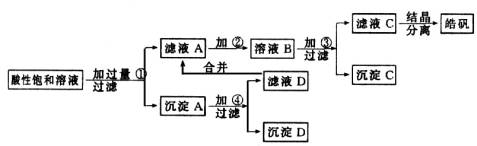
已知开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3为2.7~3.7;Fe(OH)2为7.6~9.6;Zn(OH)2为5.7~8.0。试回答下列有关问题:
(1)加入的试剂①应是________;主要反应的离子方程式有________。
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、浓HNO3等应选用________,其理由是________。
(3)加入试剂③的目的是________。
查看习题详情和答案>>

已知开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3为2.7~3.7;Fe(OH)2为7.6~9.6;Zn(OH)2为5.7~8.0。试回答下列有关问题:
(1)加入的试剂①应是________;主要反应的离子方程式有__ _____ _ 。
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、浓HNO3等应选用________,其理由是____ ____。
(3)加入试剂③的目的是______ __。
查看习题详情和答案>>