网址:http://m.1010jiajiao.com/timu3_id_8769[举报]
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质
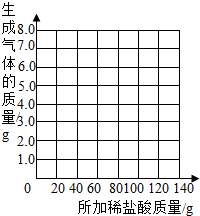
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |
 查看习题详情和答案>>
查看习题详情和答案>>
化学中质量守恒定律是一个非常重要的定量定律.
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1________m2,其原因为________.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如下所示.

①1个B分子中含有________个原子.
②四种物质中属于化合物的是________(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是10 g.有关实验数据见下表:
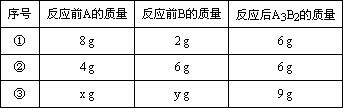
X∶Y的比值可能为________或________.
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案](1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
[进行实验]甲组同学:称取24.00 g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00 g.
乙组同学:称取24.00 g样品,加入足量的稀盐酸直到反应停止,共收集到8.80 g二氧化碳.
[解决问题]请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1%)
________.
化学中质量守恒定律是一个非常重要的定量定律.
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1________m2,其原因为________.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如图所示.
①1个B分子中含有________个原子.
②四种物质中属于化合物的是________(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是l0g.有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
【设计方案】
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00g.乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳.
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1% )________. 查看习题详情和答案>>
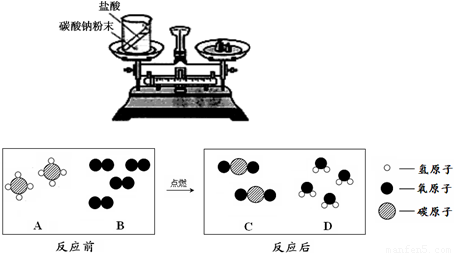
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1______m2,其原因为______.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如图所示.
①1个B分子中含有______个原子.
②四种物质中属于化合物的是______(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是l0g.有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
【设计方案】
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00g.乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳.
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1% )______.
查看习题详情和答案>>
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应;
①取少量该固体样品置于试管中,向其中加入稀盐酸,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则反应方程式为:
②如果氢氧化钠已经完全变质,甲组同学认为取少量固体溶于水,向其中滴加无色酚酞后,溶液应呈无色,乙组同学思考后认为甲组同学的想法是错误的,原因是:
.
③为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液,充分反应后过滤 | 产生白色沉淀 产生白色沉淀 |
有关反应的化学方程式为 Na2CO3+CaCl2=2NaCl+CaCO3↓ Na2CO3+CaCl2=2NaCl+CaCO3↓ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入 酚酞试液 酚酞试液 |
变红 变红 |
该样品中含有氢氧化钠 |
①甲组同学:称取20.00样品,放入过量的盐酸直到反应停止,共收集到4.40g二氧化碳.(设计思路:根据样品与盐酸反应生成二氧化碳的质量求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
②乙组同学:称取20.00g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.(设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
(1)在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:
(2)小明又重新设计新方案:先用电子秤准确称取20.00g变质的NaOH样品放入锥形瓶中,用电子秤秤得锥形瓶及样品的总质量为70.00g,再把175.00g7.3%稀盐酸平均分成7份依次加入样品中,每次充分反应用电子秤秤得锥形瓶及所盛物质的质量,实验数据记录如下:
| 加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | 第七次 |
| 锥形瓶及所盛物质的总质量 | 95.00 | 120 | 145 | 170 | 192.8 | 215.6 | 240.6 |
(不要写出计算过程)