摘要:11.已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-226kJ/mol 根据以上热化学方程式判断.下列说法正确的是( ) A.CO的燃烧热为283 kJ B.上图可表示由CO生成CO2的反应过程和能量关系 C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol D.CO(g)与Na2O2(s)反应放出509 kJ热量时.电子转移数为6.02×1023 [解析] CO的燃烧热是283 kJ/mol.A项数据的单位不对.B项的图象中.CO和CO2的物质的量都应是2 mol.由题中的反应得:2Na2O2(s)+2CO2(g)===2Na2CO3(s)+O2(g) ΔH=-452 kJ/mol.当反应物中的CO2为固态时.因为固体变成气体要吸热.所以反应放出的热量减少.而放热反应的ΔH是负值.所以C项正确.根据题中两个反应得:Na2O2===Na2CO3(s) ΔH=-509 kJ/mol.即CO(g)与Na2O2(s)反应放出509 kJ热量时.电子转移数为2×6.02×1023. [答案] C
网址:http://m.1010jiajiao.com/timu3_id_87344[举报]
已知:①2CO(g)+O2(g)═2CO2(g)△H1=-566.0kJ/mol②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
则1molC(s)在氧气中燃烧生成CO时的△H值为( )
则1molC(s)在氧气中燃烧生成CO时的△H值为( )
| A、+172.5 kJ/mol | B、-172.5 kJ/mol | C、+110.5kJ/mol | D、-110.5kJ/mol |
已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
查看习题详情和答案>>
(2013?聊城一模)研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义.
(1)已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-484kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ?mol-1
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=
(2)在密闭容器中通入物质的量浓度均为0.1mol/L的CH4 与CO2,在一定条件下发生反应
CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为
③在压强为P4、1100℃的条件下,该反应5min时达到平衡X点,则用CO表示该反应的速率为
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作过程中O2应从
查看习题详情和答案>>
(1)已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-484kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ?mol-1
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=
+160kJ?mol-1
+160kJ?mol-1
.(2)在密闭容器中通入物质的量浓度均为0.1mol/L的CH4 与CO2,在一定条件下发生反应
CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是
ac
ac
.a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为
P4>P3>P2>P1
P4>P3>P2>P1
.③在压强为P4、1100℃的条件下,该反应5min时达到平衡X点,则用CO表示该反应的速率为
0.032mol/(L?min)
0.032mol/(L?min)
,该温度下,反应的平衡常数为1.64
1.64
.(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作过程中O2应从
c
c
(填“c或b”)口通入,电池负极反应式为2CH3OH+2H2O-12e-=2CO2↑+12H+
2CH3OH+2H2O-12e-=2CO2↑+12H+
,若用该电池电解精炼铜,每得到6.4g铜,转移电子数目为0.2NA
0.2NA
.
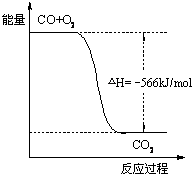 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+
已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+