网址:http://m.1010jiajiao.com/timu3_id_87312[举报]
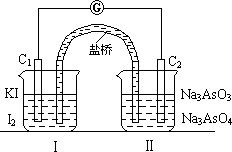
已知可逆反应AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是
A. ①操作过程中C1棒上发生的反应为2I--2e-=I2
B. ②操作过程中导线上电子定向移动方向由C2→C1
C. 若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气
D. 若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极
查看习题详情和答案>>
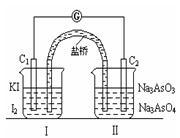
 AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是

| A.①操作过程中C1棒上发生的反应为2I--2e-=I2 |
| B.②操作过程中导线上电子定向移动方向由C2→C1 |
| C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气 |
| D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极 |
已知可逆反应AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是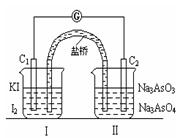
| A.①操作过程中C1棒上发生的反应为2I--2e-=I2 |
| B.②操作过程中导线上电子定向移动方向由C2→C1 |
| C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气 |
| D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极 |
|
已知可逆反应AsO43-+2I-+2H+
| |
| [ ] | |
A. |
①操作过程中C1棒上发生的反应为2I--2e-=I2 |
B. |
②操作过程中导线上电子定向移动方向由C2→C1 |
C. |
若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气 |
D. |
若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极 |
(10分)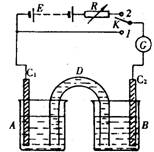 装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
1.已知AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
(1)两次操作过程中指针偏转的原因是
(2)指针偏转方向相反的原因是
(3)加盐酸时C1上发生的反应是
(4)加NaOH溶液时C1上发生的反应是
2.当 A中盛适量的1mol/L Na2SO4溶液,B中盛40mL适量浓度的KI-KHCO3溶液,且K接2时,可用该装置来测定砷的含量。其操作如下:称取5.00g含砷样品,溶解后加入还原剂,使砷全部转化为HAsO32-,除去过量的还原剂后再转移到250mL容量瓶中配成250mL溶液,用移液管从中取出10mL加入B中,边搅拌边电解,电解生成的 I2可将HAsO32-快速、定量地氧化为HAsO42-,以2mA的电流电解241s便可使反应进行完全。
(1)反应到达终点时宜用 来指示;
(2)假设电能没有损失,试求样品中As2O5的质量分数。
查看习题详情和答案>>