摘要:4.在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀.若以Ksp表示BaSO4的溶度积常数.则平衡后溶液中( ) A.[Ba2+]=[SO42-]=(Ksp) B.[Ba2+]·[SO42-]>Ksp.[Ba2+]=[SO42-] C.[Ba2+]·[SO42-]=Ksp.[Ba2+]>[SO42-] D.[Ba2+]·[SO42-]≠Ksp.[Ba2+]<[SO42-] [解析] 对于溶解平衡BaSO4(s)Ba2+(aq)+SO42-(aq).加入BaCl2溶液.平衡向左移动.[Ba2+]增大.[SO42-]减少.所以溶液中[Ba2+]>[SO42-].仍为饱和溶液.[Ba2+]·[SO42-]=Ksp. [答案] C
网址:http://m.1010jiajiao.com/timu3_id_87119[举报]
在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )?
A.[Ba2+]=[![]() ]=(Ksp)
]=(Ksp)![]()
B.[Ba2+]·[![]() ]>Ksp,[Ba2+]=[
]>Ksp,[Ba2+]=[![]() ]?
]?
C.[Ba2+]·[![]() ]=Ksp,[Ba2+]>[
]=Ksp,[Ba2+]>[![]() ]?
]?
D.[Ba2+]·[![]() ]≠Ksp,[Ba2+]<[
]≠Ksp,[Ba2+]<[![]() ]?
]?
在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
A.C(Ba2+)·C(SO42-)≠ Ksp C(Ba2+)<C(SO42-)
B.C(Ba2+)·C(SO42-)> Ksp C(Ba2+) = C(SO42-)
C.C(Ba2+)=C(SO42-)= Ksp ½
D.C(Ba2+)·C(SO42-)=Ksp C(Ba2+)>C(SO42-)
查看习题详情和答案>>
在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp) )=(Ksp)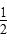 |
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |