摘要:臭氧是一种强氧化剂.常用于消毒.灭菌等. (1)O3与KI溶液反应生成的两种单质是 和 . (2)O3在水中易分解.一定条件下.O3的浓度减少一半所需的时间(t)如题29表所示.已知:O3的起始浓度为0.0216 mol/L. ①pH增大能加速O3分解.表明对O3分解起催化作用的是 . ②在30°C.pH=4.0条件下.O3的分解速率为 mol/. ③据表中的递变规律.推测O3在下列条件下分解速率依次增大的顺序为 . a. 40°C.pH=3.0 b. 10°C.pH=4.0 c. 30°C.pH=7.0 (3)O3 可由臭氧发生器电解稀硫酸制得. ①图中阴极为 .其电极反应式为 . ②若C处通入O 2 .则A极的电极反应式为 . ③若C处不通入O 2 .D.E处分别收集到xL和有yL气体.则E处收集的气体中O 3 所占的体积分数为 .(忽略 O 3 的分解). 解析:本题考察化学反应速率的概念.计算.外界条件对反应速率对影响以及有关电化学知识. (1)臭氧是一种强氧化剂.能氧化I-生成单质碘.方程式为O3+2KI+H2O=I2+2KOH+O2↑, (2)①pH增大.说明碱性增强.因此其催化剂作用的是OH-, ②由表中数据可知.在30°C.pH=4.0条件下.O3的浓度减少一半所需的时间是108min.所以其反应速率是, ③由表中数据知温度越高.pH越大.反应速率越快.所以分解速率依次增大的顺序为b.a.c, (3)①溶液中-2价的O失去电子被氧化得到臭氧.在电解池中阳极失去电子.发生氧化反应.溶液中的阳离子在阴极得到电子.发生还原反应.因此A是阴极.B是阳极,溶液中只有阳离子氢离子.所以阴极电极反应式为2H++2e-=H2↑, ②若阴极通氧气.则氧气得到电子被还原成OH-.然后结合溶液中氢离子生成水.方程式为O2+4H++4e-=2H2O, ③由以上分析知D.E分别产生的气体是氢气和氧气.臭氧的混合气体.设臭氧的体积是nL.根据得失电子守恒知.解得n=x-2y.所以臭氧的体积分数是. 答案:(1)O2 I2 (2)①OH-, ②1.00×10-4 ③b.a.c (3)①2H++2e-=H2↑ ②O2+4H++4e-=2H2O, ③
网址:http://m.1010jiajiao.com/timu3_id_86729[举报]
臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)O3与KI溶液反应生成的两种单质是
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.
①pH增大能加速O3分解,表明对O3分解起催化作用的是
②在30℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0.
查看习题详情和答案>>
(1)O3与KI溶液反应生成的两种单质是
O2
O2
和I2
I2
.(填分子式)(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
OH-
OH-
.②在30℃、pH=4.0条件下,O3的分解速率为
1.00×10-4
1.00×10-4
mol/(L?min).③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
b、a、c
b、a、c
.(填字母代号)a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0.
 (2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)O3与KI溶液反应生成的两种单质是
I2
I2
和O2
O2
.(填分子式)(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
OH-
OH-
.②在30℃、pH=4.0条件下,O3的分解速率为
1.00×10-4
1.00×10-4
mol/(L?min);③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
b、a、c
b、a、c
.(填字母代号)a. 40℃、pH=3.0 b. 10℃、pH=4.0 c. 30℃、pH=7.0
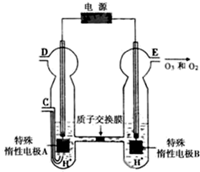
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为
A
A
(填“A”或“B”),其电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
.②若C处通入O2,则A极的电极反应式为
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
.③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为
| x-2y |
| y |
| x-2y |
| y |
 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质,其离子反应方程式为
O3+2I-+H2O=O2+I2+2OH-
O3+2I-+H2O=O2+I2+2OH-
.(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
OH-
OH-
.②在30℃、pH=4.0条件下,O3的分解速率为
1.00×10-4
1.00×10-4
mol/(L?min).③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
b、a、c
b、a、c
.(填字母代号)a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为
A
A
(填“A”或“B”),其电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
.②若C处通入O2,则A极的电极反应式为
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
.臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
|
T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看习题详情和答案>>
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)O3与KI溶液反应生成的两种单质是______和______.(填分子式)
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②在30℃、pH=4.0条件下,O3的分解速率为______mol/(L?min);
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)
a. 40℃、pH=3.0 b. 10℃、pH=4.0 c. 30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为______(填“A”或“B”),其电极反应式为______.
②若C处通入O2,则A极的电极反应式为______.
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为______(忽略O3的分解). 查看习题详情和答案>>
 pH
pH t/min
t/min