摘要:某小组为研究电化学原理.设计如图2装置.下列叙述不正确的是 A.a和b不连接时.铁片上会有金属铜析出 B.a和b用导线连接时.铜片上发生的反应为:Cu2++2e-= Cu C.无论a和b是否连接.铁片均会溶解.溶液从蓝色逐渐变成浅绿色 D.a和b分别连接直流电源正.负极.电压足够大时.Cu2+向铜电极移动 解析:本题考察原电池.电解池的原理.判断及其应用.若a和b不连接.则不能构成原电池.单质铁直接与Cu2+发生氧化还原反应而置换出铜.方程式为:Fe+Cu2+=Fe2++Cu.A正确,若a和b用导线连接.则构成原电池.此时铁作负极.铜作正极.方程式分别为:Fe-2e-=Fe2+.Cu2++2e-= Cu.B正确,有A.B分析可知.选项C是正确的,若a和b分别连接直流电源正.负极.则构成电解池.此时铜作阳极失去电子被氧化.铁作阴极.在电解池中阳离子向阴极运动.因此选项D是错误的. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_86267[举报]
 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )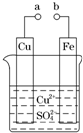 (2011?广东高考)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
(2011?广东高考)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )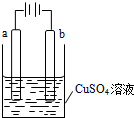 (2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
(2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( ) (2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
(2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )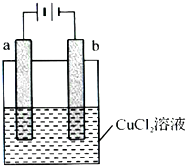 (2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( )
(2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( )