摘要:结合下图判断.下列叙述正确的是 A.Ⅰ和Ⅱ中正极均被保护 B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液.均有蓝色沉淀 解析:锌比铁活泼.装置Ⅰ中锌作负极.方程式为Zn-2e-=Zn2+.铁作正极.但溶液显中性.所以发生锌的吸氧腐蚀.正极反应是O2+2H2O+4e-=4OH-,铁比铜活泼.装置Ⅱ中铁作负极.负极反应为Fe-2e-=Fe2+.铜作正极.但溶液显酸性.所以正极是溶液中的氢离子得电子.方程式为2H++2e-=H2↑.因为装置Ⅰ中没有Fe2+生成.所以装置Ⅰ中加入少量K3Fe(CN)6溶液时.没有蓝色沉淀产生.综上所叙.只有选项A是正确的. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_86265[举报]
结合下图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极均被保护
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
查看习题详情和答案>>
结合下图判断,下列叙述正确的是

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=== Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=== 4OH-
D.Ⅰ和Ⅱ中灯泡均会发亮
查看习题详情和答案>>
结合下图判断,下列叙述正确的是 ( )
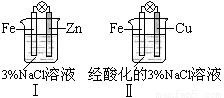
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
查看习题详情和答案>>

