摘要:硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体.实验室中常以废铁屑为原料来制备.其步骤如下: 步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污.分离出液体.用水洗净铁屑. 步骤2 向处理过的铁屑中加入过量的3mol·L-1H2SO4溶液.在60℃左右使其反应到不再产生气体.趁热过滤.得FeSO4溶液. 步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液.经过“一系列操作 后得到硫酸亚铁铵晶体. 请回答下列问题: (1) 在步骤1的操作中.下列仪器中不必用到的有 ①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥ 玻璃棒 ⑦ 酒精灯 (2) 在步骤2中所加的硫酸必须过量.其原因是 , (3) 在步骤3中.“一系列操作 依次为 . 和过滤, (4) 本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是 .可以观察到得现象是 . [答案]抑制亚铁离子的水解和氧化,(3)加热浓缩.冷却结晶,(4)KSCN溶液.溶液显血红色 命题立意:实验综合能力考查.本题考查点有溶液加热.过滤.固体溶解.蒸发.结晶等一系列实验. 解析:步骤1是溶液加热和过滤操作.用不到②④⑤,亚铁离子在加热过程中有水解.因而要加酸抑制亚铁离子的水解,步骤3是抑制亚铁离子的水解下的蒸发与结晶过程, [思维拓展]实验综合题不仅仅要考查操作方面的内容.也考查一些理论知识在实验过程中的运用.因而实验综合题历来是高考中的难点.操作要点在平时复习中注意积累.分析过程中可能要注意的问题.要紧扣实验目的.多方面考虑.才可确保万无一失.
网址:http://m.1010jiajiao.com/timu3_id_86209[举报]
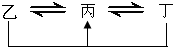 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:(1)写出化合物甲的电子式:


(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
H2O2分子间存在氢键
H2O2分子间存在氢键
.(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
,析出该复盐晶体的原理是硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
.浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4?FeSO4?6H2O]比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
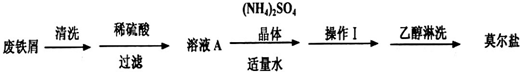
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
证明溶液A不含Fe3+离子的最佳试剂是
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接

将装置C中两种液体分离开的操作名称是
查看习题详情和答案>>

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
防止Fe2+离子被氧化为Fe3+离子
防止Fe2+离子被氧化为Fe3+离子
;证明溶液A不含Fe3+离子的最佳试剂是
b
b
(填序号字母).a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
冷却结晶
冷却结晶
、过滤.(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
.(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
左
左
(填“左”“右”)盘.(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接
d
d
;e
e
接f
f
.
将装置C中两种液体分离开的操作名称是
分液
分液
.装置D的作用是吸收多余的NH3防止污染空气,防止倒吸
吸收多余的NH3防止污染空气,防止倒吸
.
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,是浅绿色晶体,商品名为莫尔盐,易溶于水,不溶于乙醇.
完成下面的实验报告:
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全). ,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体干燥后称得质量为m2g.
①a处的操作是 ;
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止. ,得到硫酸亚铁铵的晶体.过滤后用无水乙醇洗涤晶体,除去其表面的水分,称量得到的晶体质量为m3g.
①b处的操作是 ;②制备莫尔盐晶体时,为什么不能将溶液蒸发至干?
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
查看习题详情和答案>>
| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全).
①a处的操作是
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.
①b处的操作是
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
(2012?大兴区一模)亚铁盐在空气中易被氧化,但是形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示:
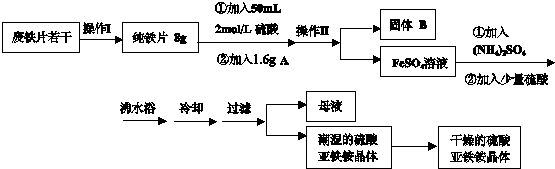
请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
a.H2O b.3mol?L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是
(3)操作Ⅱ的名称是
(4)加入少量硫酸可以调节pH为1~2,其作用是
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:
(6)在此流程中,理论上得到硫酸亚铁铵晶体
相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是
查看习题详情和答案>>

请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
c
c
(填序号) a.H2O b.3mol?L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是
形成微小原电池,加快铁与硫酸反应速率
形成微小原电池,加快铁与硫酸反应速率
,则固体B的成分为铁和铜
铁和铜
.(3)操作Ⅱ的名称是
过滤
过滤
,所用主要玻璃仪器有:烧杯、玻璃棒、漏斗
玻璃棒、漏斗
.(4)加入少量硫酸可以调节pH为1~2,其作用是
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
(结合化学用语和简要语言说明).(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
.(6)在此流程中,理论上得到硫酸亚铁铵晶体
39.2
39.2
g(精确到小数点后两位).相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
| ||
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
.
| ||
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
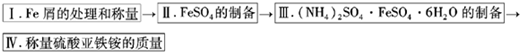
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)称量生成的硫酸亚铁铵的质量,理论上为
查看习题详情和答案>>
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
实验步骤流程图:

请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为
10%Na2CO3溶液
10%Na2CO3溶液
,经处理后的干燥铁屑质量记为m1;(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
3.13(m1-m2)
3.13(m1-m2)
g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用无水乙醇
无水乙醇
洗涤晶体.(4)称量生成的硫酸亚铁铵的质量,理论上为
7(m1-m2)
7(m1-m2)
g.