网址:http://m.1010jiajiao.com/timu3_id_86207[举报]

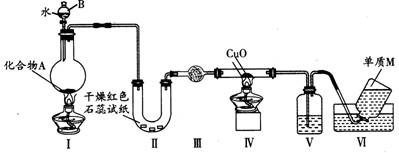
(1)仪器B的名称是
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色,并有M生成,则Ⅲ中的试剂为
| ||
| ||
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ-Ⅲ-Ⅳ-Ⅱ-Ⅴ-Ⅵ,此时Ⅱ中现象为
(4)经上述反应,2.5g化合物A理论上可得到0.56L(标准状况)M,则A的化学式为
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是 。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为 ;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ→Ⅲ→Ⅳ→Ⅱ→Ⅴ→Ⅵ,此时Ⅱ 中现象为 ,原因是 。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。
(14分)固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是__ ______。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________ 。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为___ _____,原因是___ _______________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为_________ _______。
查看习题详情和答案>>
(14分)固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。

(1)仪器B的名称是__ ______。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________ 。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为___ _____,原因是___ _______________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为_________ _______。
查看习题详情和答案>>