摘要: (1)3Cu2O+14H++2NO===6Cu2++2NO↑+7H2O 0.1 mol
网址:http://m.1010jiajiao.com/timu3_id_85936[举报]
将SO2少量通入Fe2(SO4)3溶液中发生反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;然后再加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.下列判断正确的是( )
查看习题详情和答案>>
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.其中一种方法是还原沉淀法
该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
查看习题详情和答案>>
该法的工艺流程为:CrO42-
| H+ |
| ①转化 |
| Fe3+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
C
C
.A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
6
6
mol的FeSO4?7H2O.写出第②步中反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O下列有关说法正确的是( )
| A、还原性Cr3+>Fe2+>SO2 | B、②中当有1mol Fe3+生成时转移的电子数目为NA | C、Cr2O72-能将Na2SO3氧化成Na2SO4 | D、两个反应中Fe2(SO4)3均作还原剂 |
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
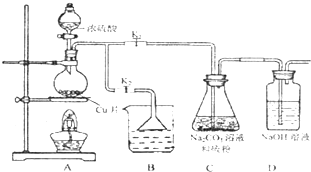
(1)某研究小组设计了制备Na2S203_5H20装置和部分操作步骤如图.
I.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉的域逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是
②IV中,操作步骤是
③装置B中盛放的试剂是(填化学式)
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO
2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O
2- 7 |
②I2+2S2O
2- 3 |
2- 6 |
则判断达到滴定终点的现象是
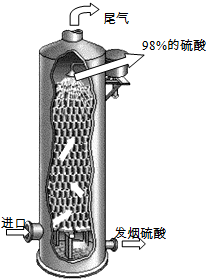 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | -- | 6.9% |
2SO2(g)+O2(g)?2SO3(g)△H=-
kJ/mol
| 800Q |
| a |
2SO2(g)+O2(g)?2SO3(g)△H=-
kJ/mol
.| 800Q |
| a |
(2)已知在SO2催化氧化前后混合气体中各成分的体积分数如表,则SO2的转化率为
95.3%
95.3%
.(3)如图所示,用98%的浓硫酸1.0t吸收SO3制得发烟硫酸(化学组成可表示为H2SO4?xSO3),可生产SO3质量分数为20%的发烟硫酸
1.36
1.36
t.(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000mol?L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?(假设杂质不参加反应).