网址:http://m.1010jiajiao.com/timu3_id_85892[举报]
A.溶液中[Fe2+]<[Fe3+] B.溶液中[Fe2+]>[Fe3+]?
C.部分铁被氧化 D.部分Fe3+被还原?
查看习题详情和答案>>
( 12分 ) 已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:

某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。

( 1 ) CH3COOOH称为过氧乙酸,写出它的一种用途 _________ 。
( 2 ) 写出 B + E ![]() CH3COOOH + H2O 的化学方程式 ____________________ 。
CH3COOOH + H2O 的化学方程式 ____________________ 。
( 3 ) 写出F可能的结构简式 __________________ 。
( 4 ) 写出A的结构简式 ______________________ 。
( 5 ) 1 mol C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是 _____ 。
( 6 ) 写出D跟氢溴酸 ( 用溴化钠和浓硫酸的混合物 ) 加热反应的化学方程式:
______________________________________________________ 。
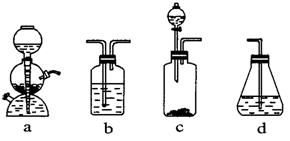
查看习题详情和答案>>( 12分 ) 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验: 先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
![]() b
b ![]()
![]() b
b
(电石、水) ( ) ( ) ( 溴水 )
乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少量还原性的杂质气体。由此他提出必须先除去之,再与溴水反应。
请回答问题:
( 1 ) 写出甲同学实验中两个主要的化学方程式 _______________________________ 。
( 2 ) 甲同学设计的实验 ________ ( 填“能”或“不能” ) 验证乙炔与溴发生加成反应,其理由是 __________________________________________ 。
a. 使溴水褪色的反应,未必是加成反应
b. 使溴水褪色的反应,就是加成反应
c. 使溴水褪色的物质,未必是乙炔
d. 使溴水褪色的物质,就是乙炔
( 3 ) 乙同学推测此乙炔中必定含有的一种杂质气体是 ________ ,它与溴水反应的化学方程式是 __________________________ 。验证过程中必须全部除去。
( 4 ) 请你选用上列四个装置 ( 可重复使用 ) 来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
( 5 ) 为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是什么?
查看习题详情和答案>>(12分)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A:
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii
①H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是______________.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
⑧投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看习题详情和答案>>
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
查看习题详情和答案>>