网址:http://m.1010jiajiao.com/timu3_id_85824[举报]
(1)工业高炉炼铁采用焦炭、铁矿石等于高炉中共热,并鼓入适量空气,让高温下产生的CO气体还原铁矿石制得铁。这种方法不可避免地混入了非金属单质——碳。纯铁的抗腐蚀能力相当强,而铁碳合金却易发生电化腐蚀。
①写出钢铁发生吸氧腐蚀时的正极反应____________________________________。
②为保护钢铁制品不被腐蚀,可采用的电化学防护方法是(答出一种电化学防护方法的名称)____________________________________。
(2)焊接无缝钢轨时常采用铝热反应制备铁,中学教材中也有Al和Fe2O3的铝热反应实验。
①有人推测,铝热反应实验中所得熔融物中可能混有Al。若用一个简单实验证明含Al,则应选用的试剂是____________,能证明含铝的现象是__________________________。
②若经实验证实熔融物含铝,欲将该熔融物完全溶解,下列试剂中最适宜的是____________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀HNO3 D.NaOH溶液
③实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,直到还原成铵根离子(![]() )。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:
)。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:

试回答下列问题:
Ⅰ.图中DE段沉淀的物质的量没有变化,此段发生反应的离子方程式为_________________。
Ⅱ.通过图象判断溶液中的离子结合OH-能力最强的是________________,最弱的是________________。
Ⅲ.EF段反应的离子方程式是________________,A与B 的差值是________________mol。
查看习题详情和答案>>实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。
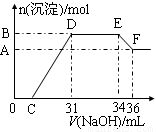
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1
查看习题详情和答案>>
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。
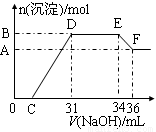
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中,铝的质量为 g,铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1。
查看习题详情和答案>>
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.问题:(1)铁粉与铝粉的混合物与该浓度硝酸反应后,溶液中的阳离子除了Al3+、Fe3+、另外还有
(2)B与A的差值为
(3)写出DE段离子反应方程式
(4)原混合物中铝粉与铁粉的物质的量之比为
(5)原硝酸溶液中含硝酸的物质的量为
