摘要:13.2SO2(g)+O2(g)2SO3(g).反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol. 请回答下列问题: (1)图中A.C分别表示 . .E的大小对该反应的反应热有无影响? .该反应通常用V2O5作催化剂.加V2O5会使图中B点升高还是降低? .理由是 , (2)图中ΔH= kJ/mol, (3)V2O5的催化循环机理可能为:V2O5氧化SO2时.自身被还原为四价钒化合物,四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式 , (4)如果反应速率v(SO2)为0.05 mol/.则v(O2)= mol/. v(SO3)= mol/, (5)已知单质硫的燃烧热为296 kJ/mol.计算由S(s)生成3 mol SO3(g)的ΔH= .
网址:http://m.1010jiajiao.com/timu3_id_85711[举报]
A、B、C均为常见的物质,且有如下转化关系:
(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
②用石墨电极电解B的饱和溶液时,观察到的现象是
阳极反应式为
(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
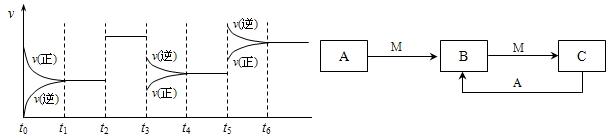
①若C在一定条件下可发生如下的反应:2SO2+O2 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
查看习题详情和答案>>

(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 H2CO3+OH-
H2CO3+OH-HCO3-+H2O H2CO3+OH-
H2CO3+OH-
. H2CO3+OH-
H2CO3+OH-②用石墨电极电解B的饱和溶液时,观察到的现象是
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
,阳极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,电解一段时间后,溶液的pH不变
不变
(填“增大”、“减小”或“不变”).(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
极性共价键
极性共价键
.①若C在一定条件下可发生如下的反应:2SO2+O2
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是A
A
.A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2
 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
<
<
b,m<
<
n(填“>”、“=”或“<”,下同).若改为等温等压,则a═
═
b,m═
═
n. 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )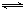 2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( )
2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( )