摘要:14.(1)2Fe―→2Fe2++4e- 2H2O+O2+4e-―→4OH- (2)Fe2++2OH-===Fe(OH)2↓.4Fe(OH)2+O2+2H2O===4Fe(OH)3 (3)4Fe+3O2+6H2O―→4Fe(OH)3
网址:http://m.1010jiajiao.com/timu3_id_85638[举报]
(1)AgNO3的水溶液呈
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如右图所示.则图中表示醋酸溶液中pH变化曲线的是
(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸 门上的固体材料R可以采用
门上的固体材料R可以采用
A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是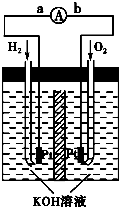 方向为
方向为
②负极反应式为
③电极表面镀铂粉的原因为
查看习题详情和答案>>
酸
酸
(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):Ag++H2O  AgOH+H+
AgOH+H+
 AgOH+H+
AgOH+H+Ag++H2O  AgOH+H+
AgOH+H+
;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的 AgOH+H+
AgOH+H+硝酸
硝酸
中,然后再用蒸馏水稀释到所需的浓度.若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式4Ag++2H2O
4Ag+O2↑+4H+
| ||
4Ag++2H2O
4Ag+O2↑+4H+
,
| ||
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
向红色溶液中加入足量BaCl2溶液
向红色溶液中加入足量BaCl2溶液
如果溶液还显红色说明甲正确,红色褪去说明乙正确
如果溶液还显红色说明甲正确,红色褪去说明乙正确
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化

如右图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:
2Fe=2Fe2++4e-
2Fe=2Fe2++4e-
正极:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸
 门上的固体材料R可以采用
门上的固体材料R可以采用C
C
.A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
负
负
极.(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动 方向为
方向为a→b
a→b
(用a、b表示).②负极反应式为
2H2+4OH-=4H2O+4e-
2H2+4OH-=4H2O+4e-
.③电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
.C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
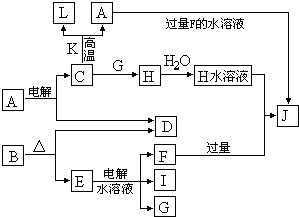
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式: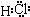
 .
.
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
(4)写出A+F→J的离子方程式:
查看习题详情和答案>>

请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
H2O2
H2O2
;G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
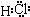
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
2KCl+2H2O
2KOH+Cl2↑+H2↑
| ||
2KCl+2H2O
2KOH+Cl2↑+H2↑
,当溶液的pH=13时,理论上生成G的单质在标准状况下的体积为
| ||
1.12L
1.12L
;若将上述两电极材料调换,则阳极上的电极反应为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
| ||
(4)写出A+F→J的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为( )
A.4H++ 4e-= 2H2↑ B.2H2O+O2+ 4e一 =4OH-
C.2Fe =2Fe2++ 4e- D.4OH一=2H2O+O2↑+4e一
查看习题详情和答案>>室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适的条件下,它们按如图进行转化,D溶液为棕黄色,E溶液无色,F溶液为浅绿色.

请回答下列问题:
(1)B、C分别是
(2)反应①的化学方程式是
(3)反应④的离子方程式是
(4)反应⑤的离子方程式是
查看习题详情和答案>>

请回答下列问题:
(1)B、C分别是
Cl2
Cl2
、H2
H2
.(2)反应①的化学方程式是
2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
.
| ||
(3)反应④的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(4)反应⑤的离子方程式是
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2013?天津)FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
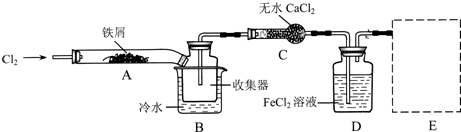
①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中冷水浴的作用为
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②
查看习题详情和答案>>
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为
2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
.
| ||
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是
在沉积的FeCl3固体下方加热
在沉积的FeCl3固体下方加热
.(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
②⑤
②⑤
.(4)装置B中冷水浴的作用为
冷却,使FeCl3沉积,便于收集产品
冷却,使FeCl3沉积,便于收集产品
;装置C的名称为干燥管
干燥管
;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:KMnO4溶液
KMnO4溶液
.(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为
2Fe3++H2S=2Fe2++S↓+2H+
2Fe3++H2S=2Fe2++S↓+2H+
.(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为
Fe2+-e-=Fe3+
Fe2+-e-=Fe3+
.(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②
FeCl3得到循环利用
FeCl3得到循环利用
.