摘要:4.铅蓄电池的充.放电反应方程式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O.关于铅蓄电池的说法正确的是 ( ) A.在放电时.正极发生的反应是:Pb+SO―→PbSO4+2e- B.在放电时.该电池的负极材料是铅板 C.在充电时.电池中硫酸的浓度不断变小 D.在充电时.阳极发生的反应是:PbSO4+2e-―→Pb+SO
网址:http://m.1010jiajiao.com/timu3_id_85624[举报]
|
铅蓄电池的充、放电反应方程式为:Pb+PbO2+2H2SO4 | |
| [ ] | |
A. |
在放电时,正极发生的反应是:Pb+SO |
B. |
在放电时,该电池的负极材料是铅板 |
C. |
在充电时,电池中硫酸的浓度不断变小 |
D. |
在充电时,阳极发生的反应是:PbSO4+2e-→Pb+SO |
铅蓄电池的总反应方程式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O.下列说法正确的是( )
| 充电 |
| 放电 |
| A、放电时,负极的电极反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| B、充电时,电解液中H2SO4的浓度将变小 |
| C、放电时,转移l mol电子,参加反应的铅有0.5mol |
| D、充电时,蓄电池的负极和外接电源的正极相连 |
铅蓄电池可放电亦可充电,具有双重功能。它是用硬橡胶或透明塑料制成的长方形外壳,在正极板上有一层棕褐色的PbO2,负极板上是海绵状的金属铅,两极均浸在一定浓度的硫酸溶液中,且两极间用微孔橡胶或微孔塑料隔开。
电极反应: 负极:Pb+![]() -2e-
-2e-![]() PbSO4
PbSO4
正极:PbO2+![]() +4H++2e-
+4H++2e-![]() PbSO4+2H2O
PbSO4+2H2O
总反应式:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
下列对铅蓄电池的叙述正确的是( )
A.充电时化学能转化成电能
B.充电时电能转化为化学能
C.在充、放电过程中只有化学能与电能间的转化
D.在充、放电过程中也有其他形式能的转化,如电能转化为热能
查看习题详情和答案>>铅蓄电池具有电压高,放电容量大,经济上较便宜等特点,广泛用于汽车、拖拉机、轮船做启动与照明电源.已知:铅蓄电池充电完毕后,电池中硫酸的密度为ρ1,放电完毕后,溶液的密度变为ρ2.又铅蓄电池放电和充电时的反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O如图所示的装置,表示铅蓄电池工作示意简图试回答:
2PbSO4+2H2O如图所示的装置,表示铅蓄电池工作示意简图试回答:
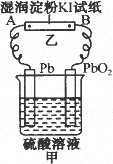
(1)写出铅蓄电池(装置甲)工作时电极反应方程式:________.
(2)写出装置甲工作一段时间后,装置乙中A、B两端观察到的现象.写出有关反应的电极方程式________.
(3)已知充、放电完毕后,溶液的密度是下列两个数据:1.10 g·cm-3,相当于含溶质质量分数为14.35%的硫酸、1.28 g·cm-3,相当于含溶质质量分数为36.87%的硫酸,请指出ρ1、ρ2分别对应于哪个数据?
 (1)铅蓄电池的电池总反应式为:
(1)铅蓄电池的电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 | 充电 |
①放电时:负极的电极反应式是
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,电解液中H2SO4的浓度将变小
小
,当外电路通过2mol电子时,理论上负极板的质量增加96
96
g.②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板按右图连接,电解一段时间后,则在A电极上生成
Pb
Pb
,B电极上生成PbO2
PbO2
.(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是
cd
cd
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.