摘要:13.(1)Fe3+.Mg2+.CO.Ba2+ Cl- (2)SO 0.5 mol/L NH 0.2 mol/L Al3+ 0.2 mol/L (3)是 溶液中肯定存在的离子是NH.Al3+.SO.经计算.NH.Al3+物质的量都是0.02 mol.SO物质的量是0.05 mol.根据电荷守恒.K+一定存在
网址:http://m.1010jiajiao.com/timu3_id_85575[举报]
 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO2- 3 |
- 3 |
(1)取少量该溶液,滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成.
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用如图表示.
试推断:
(1)该溶液中一定存在
(2)上述溶液中至少有
(3)写出图中a→b变化过程的离子方程式
温州市地处沿海,海水资源丰富,海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO.盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等.制备流程如图1:
(1)滤渣的成分是
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图2所示.请回答下列问题:
①写出P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式
②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
查看习题详情和答案>>

(1)滤渣的成分是
Fe(OH)3、CaSO4
Fe(OH)3、CaSO4
(写化学式);滤液Ⅱ中所含主要的杂质离子是Na+
Na+
(写离子符号).为了加快过滤速度,常采用减压过滤,写出组装减压过滤装置的主要硅酸盐仪器名称布氏漏斗
布氏漏斗
,抽滤瓶或吸滤瓶
抽滤瓶或吸滤瓶
.(写2种即可)(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
;加入NaClO的另一个作用是将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
.(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图2所示.请回答下列问题:
①写出P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式
Mg(OH)Cl=MgO+HCl↑
Mg(OH)Cl=MgO+HCl↑
;②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
;若要得到无水MgCl2须采取的措施是通入HCl,而增大P(HCl)g,抑制镁离子的水解;
通入HCl,而增大P(HCl)g,抑制镁离子的水解;
.(6分))有一瓶澄清溶液, 可能含有大量H+、NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO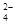 、CO
、CO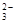 、NO
、NO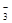 、Cl-、I-,现进行如下实验:
、Cl-、I-,现进行如下实验:










 (1)测知溶液显强酸性;
(1)测知溶液显强酸性;
(2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;

 (3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;

 (5)将实验(3)中的碱性溶液加热, 有气体放出,
该气体能使湿红色石蕊试纸变蓝。
(5)将实验(3)中的碱性溶液加热, 有气体放出,
该气体能使湿红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有 ;
溶液中肯定不存在的离子有 ;
溶液中不能确定是否存在的离子有 。
查看习题详情和答案>>
 、CO
、CO 、
、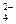 、CO
、CO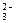 、NO
、NO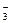 、Cl-、I-,现进行如下实验:
、Cl-、I-,现进行如下实验: