摘要:(2010·武汉市武昌区调研)一定条件下.在体积为10 L的密闭容器中.1 mol X和1 mol Y进行反应:2X.经60 s达到平衡.生成0.3 mol Z.下列说法正确的是( ) A.以X浓度变化表示的反应速率为0.001 mol/ B.将容器体积变为20 L.Z的平衡浓度为原来的1/2 C.若增大压强.则物质Y的转化率减小 D.若升高温度.X的体积分数增大.则该反应的ΔH>0 解析:以Z表示的反应速率为v(Z)==0.0005 mol/.根据同一反应中不同物质表示的反应速率之比等于化学计量数之比.则v(X)=2v.A对,将容器体积变为20 L.则压强减小.平衡向逆反应方向移动.Z的物质的量减小.则Z的平衡浓度小于原来的1/2.B错,增大压强.平衡向正反应方向移动.Y的转化率增大.C错,升高温度.X的体积分数增大.说明平衡向逆反应方向移动.而升高温度平衡向吸热反应方向移动.则正反应为放热反应.ΔH<0.D错. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_85259[举报]
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)⇌Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看习题详情和答案>>
一定条件下,在体积为10 L的密闭容器中,2 mol A和2
mol B 进行反应:2A(g) +B(g)  C(g),经60s达到平衡,生成0.6 mol C。下列说法正确的是
C(g),经60s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.002 mol·(L·s)-1
B.若增大压强,则物质B 的转化率减小
C.若升高温度,A的体积分数增大,则该反应的△H>0
D.将容器体积变为20 L,C的平衡浓度变为原来的1/2
查看习题详情和答案>>
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
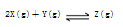 ,经60 s达到平衡生成0.3
mol Z,下列说法正确的是
,经60 s达到平衡生成0.3
mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
查看习题详情和答案>>
 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(
)
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(
)