摘要:已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),ΔH=-49.0 kJ·mol-1.一定条件下.向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2.测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中.正确的是( ) A.升高温度能使增大 B.反应达到平衡状态时.CO2的平衡转化率为75% C.3 min时.用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 D.从反应开始到平衡.H2的平均反应速率v(H2)=0.075 mol·L-1·min-1 解析:该反应ΔH<0.为放热反应.升高温度.平衡向逆反应方向移动.n(CH3OH)减小.n(CO2)增大.减小.A错,反应达平衡时.CO2的转化率为×100%=75%.B对,3 min时.c(CH3OH)=c(CO2).由于3 min后c(CH3OH)增大.c(CO2)减小.即v正>v逆.因此用CO2的浓度表示的正反应速率大于用CH3OH的浓度表示的逆反应速率.C错,0-10 min内.v(CO2)==0.075 mol·L-1·min-1.根据同一反应中用不同物质表示的反应速率之比等于化学计量数之比.v(H2)=3v(CO2)=0.225 mol·L-1·min-1.D错. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_85258[举报]
 已知:CO2(g)+3H2(g)
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )
查看习题详情和答案>>
 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )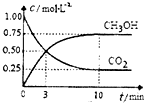 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.OkJ?mol-1 一定条件下,向体积为11的密闭容器中充入lmolCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.OkJ?mol-1 一定条件下,向体积为11的密闭容器中充入lmolCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中正确的是( )| A、升高温度平衡常数K增大 | B、反应达到平衡状态时,CO2的平衡转化率为75% | C、3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | D、从反应开始到平衡,H2的平均反应速率v (H2)=0.075mol?L-1?min-1 |
 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示.下列叙述中,正确的是( )| A、升高温度能使平衡向正反应方向移动 | B、从反应开始到平衡,v(H2)=0.075mol?L-1?min-1 | C、3 min时,V(CO2)正=V(CH3OH)逆 | D、反应达到平衡状态时,CO2的平衡转化率为75% |
 (2010?揭阳二模)已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
(2010?揭阳二模)已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )