摘要:0.05 mol x y 则x=0.05×5=0.25 mol V(O2)=0.25 mol×22.4 L/mol=5.6 L y=0.05×2=0.1 mol 根据磷原子守恒可判断0.1 mol P2O5与水反应生成0.2 mol H3PO4 则c(H3PO4)==4.00 mol/L. (2)n(H2O)==0.9 mol 由质量守恒可得生成难溶盐中含0.5 mol Ca.0.3 mol P.0.1 mol H和1.3 mol O.即难溶盐中N(Ca)∶N(P)∶N(H)∶N(O)=5∶3∶1∶13.其化学式为Ca5(PO4)3(OH). (3)混合卤化磷中分子结构有3种的是PCl3Br2和PCl2Br3.其相对分子质量为297.5和342. 答案:(1)5.6 4.00 (2)Ca5(PO4)3(OH) (3)297.5或342
网址:http://m.1010jiajiao.com/timu3_id_85024[举报]
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
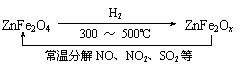
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
查看习题详情和答案>>|
现将足量AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 ①20 ml 0.01 mol·L-1 KCl溶液 ②30 ml 0.02 mol·L-1 CaCl2溶液 ③40 ml 0.03 mol·L-1 HCl溶液 ④10 ml蒸馏水 ⑤50 ml 0.05 mol·L-1AgNO3溶液 | |
| [ ] | |
A. |
①>②>③>④>⑤ |
B. |
④>③>⑤>②>① |
C. |
⑤>④>②>①>③ |
D. |
④>①>③>②>⑤ |