摘要:3.下列说法正确的是( ) A.原子最外层电子数为2的元素一定处于周期表ⅡA族 B.主族元素X.Y能形成XY2型化合物.则X与Y的原子序数之差可能为2或5 C.氯化氢的沸点比氟化氢的沸点高 D.同主族元素形成的氧化物的晶体类型均相同 解析:He原子最外层电子数为2.元素周期表副族中某些元素原子最外层电子数也是2.A错,形成XY2型化合物的X.Y可以分别是ⅡA族和ⅦA族.如MgCl2.此时原子序数相差5.X.Y也可以分别是ⅣA族和ⅥA族.如CO2.此时原子序数相差2.B正确,由于HF分子间存在氢键.故氯化氢的沸点低于氟化氢的沸点.C错,CO2晶体是分子晶体.SiO2晶体是原子晶体.D错. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_84981[举报]
将9 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.075mo
B.稀硝酸的物质的量浓度为0.5mol·L-1
C.第一次剩余4.8g金属为铜和铁
D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO
查看习题详情和答案>>
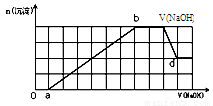
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如下所示,下列说法正确的是
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+[来源:学.科.网]
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4

查看习题详情和答案>>
500mlKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500ml,下列说法正确的是
| A.原混合溶液中c(K+)=4mol·L-1 |
| B.电解得到的Cu的物质的量为0.5mol |
| C.电解后溶液中c(H+)=2mol·L-1 |
| D.向电解后的溶液中加入一定量的Cu(OH)2可恢复为原溶液 |