摘要:14.向盛有KI溶液的试管中加入少许CCl4后滴加氯水.CCl4层变成紫色.如果继续向试管中滴加氯水.振荡.CCl4层会逐渐变浅.最后变成无色. 完成下列填空: (1)写出并配平CCl4层由紫色变成无色的化学反应方程式: + + ―→ + (2)整个过程中的还原剂是 . (3)把KI换成KBr.则CCl4层变为 色,继续滴加氯水.CCl4层的颜色没有变化.Cl2.HIO3.HBrO3氧化性由强到弱的顺序是 . 解析:(1)KI溶液中加入少量氯水.I-被氧化成I2而使CCl4层呈紫色.继续加入氯水后.I2又会被氯水氧化成HIO3.而Cl2被还原成HCl.化学方程式为I2+5Cl2+6H2O===2HIO3+10HCl. 中发生的化学反应判断KI和I2为该反应过程中的还原剂. (3)由Cl2能将I2氧化成HIO3可知氧化性Cl2>HIO3.而Cl2不能将Br2氧化成HBrO3.故氧化性HBrO3>Cl2.即氧化性HBrO3>Cl2>HIO3. 答案:(1)I2+5Cl2+6H2O===2HIO3+10HCl (2)KI.I2 (3)红棕 HBrO3>Cl2>HIO3
网址:http://m.1010jiajiao.com/timu3_id_84973[举报]
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是( )
A.上层为紫色液体,下层为无色液体 B.上层为无色液体,下层为紫色液体
C.均为紫色液体 D.上层为橙色液体,下层为紫色液体
查看习题详情和答案>>
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是
- A.上层为紫色液体,下层为无色液体
- B.上层为无色液体,下层为紫色液体
- C.均为紫色液体
- D.上层为橙色液体,下层为紫色液体
|
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是 | |
A. |
上层为紫色液体,下层为无色液体 |
B. |
上层为无色液体,下层为紫色液体 |
C. |
均为紫色液体 |
D. |
上层为橙色液体,下层为紫色液体 |
向盛有KI溶液的试管中加入一定量CCl4后,滴加少量氯水,振荡,CCl4层变成紫色,继续滴加氯水,振荡,CCl4层颜色会逐渐变浅直至无色.下列说法正确的是( )
| A、CCl4层显紫色是因为有I2生成 | B、CCl4层颜色变浅是因为I2变成I- | C、CCl4层显紫色是因为有Cl2生成 | D、CCl4层颜色变无色是因为I2的升华 |
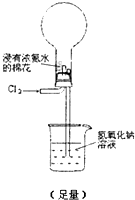 通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.实验一:说明氯的氧化性强于碘.
Ⅰ.向盛有KI溶液的试管中加入少许CCl4后,滴加新制氯水,振荡,CCl4层变成紫色.
用离子方程式表示CCl4层变紫色的原因
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
Ⅱ.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
CCl4层最后变成无色的原理如下,完成并配平该反应:
5
5
Cl2
Cl2
+1
1
I2+6
6
H2O
H2O
→2
2
HIO3+10
10
HCl
HCl
Ⅲ.氯的非金属性比碘强,用原子结构解释原因:
同主族元素从上到下原子核外电子层数依次增多
同主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱.
实验二:说明氯元素的氧化性强于氮元素
下面装置(烧瓶内已无空气)能实现Cl2置换N2的反应,请回答:
通入 Cl2 后:
Ⅰ.现象一:烧瓶中会出现白烟.白烟的成分是
NH4Cl
NH4Cl
.Ⅱ.现象二:形成喷泉,NaOH溶液进入烧瓶.烧瓶内压强减小的原因是
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
. 写出NaOH在烧瓶内发生反应的离子方程式NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
Ⅲ.除上述现象外,能说明有N2产生的实验现象是
液体不能充满烧瓶
液体不能充满烧瓶
.