网址:http://m.1010jiajiao.com/timu3_id_84833[举报]
向2 L密闭容器中通入a mol气体 A和b mol气体B,在一定条件下发生反应;xA(g)+yB(g)  pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少a/2mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=__________;
(2)化学方程式中,x=________、y=________、p=______、q=________;
(3)反应平衡时,D为2a mol,则B的转化率为__________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的ΔH________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率____________(填“增大”、“减小”或“不变”),理由是________________________________________________________;
②平衡时反应物的转化率__________(填“增大”、“减小”或“不变”),理由是
_________________________________________________________________;
查看习题详情和答案>>
 pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a2 mol,有a mol D生成.回答下列问题: (1)反应2 min内,vA=________________,vB=________________;
(2)化学方程式中,x=________、y=________、p=________、q=________;
(3)反应平衡时,D为2a mol,则B的转化率为________________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH______0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”、“减小”或“不变”),理由是__________________;
②平衡时反应物的转化率________(填“增大”、“减小”或“不变”),理由是________________________________________________________________________.
向2 L密闭容器中通入a mol气体 A和b mol气体B,在一定条件下发生反应;xA(g)+yB(g)![]() pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少a/2 mol,有a mol D生成.
回答下列问题:
(1)反应2 min内,vA=________;
(2)化学方程式中,x=________、p=________;
(3)反应平衡时,D为2a mol,则B的转化率为________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的ΔH________0(填“>”、“<”或“=”);
(10分)(1)一定条件下,发生反应CO (g)+H2O (g)  CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应 2 NO2 2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
请回答:若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则曲线B此条件可能是________(填“增大压强”、 “减小压强”“升高温度”“降低温度”或“使用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol/L,c(O2)=1.3 mol/L,则反应②中NO2的转化率为________
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
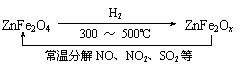
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
查看习题详情和答案>>