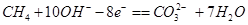摘要:9.(2010·龙岩市高三第二次质检)燃料电池是燃料(如CO.H2.CH4等)跟氧气起反应将化学能转变为电能的装置.电解质溶液是强碱溶液.下面关于甲烷燃料电池的说法正确的是( ) A.负极反应式:O2+2H2O+4e-===4OH- B.负极反应式:CH4+8OH--8e-===CO2↑+6H2O C.随着放电的进行.溶液的pH值不变 D.放电时溶液中的阴离子向负极移动 解析:得电子发生还原反应是正极.失去电子发生氧化反应是负极.O2+2H2O+4e-===4OH-应为正极反应式.燃料氧化生成的二氧化碳不可能从强碱溶液中逸出.它将进一步反应转化成碳酸根.所以负极反应式为:CH4+10OH--8e-===CO+7H2O.由于部分碱液和二氧化碳反应.所以溶液的pH值将减小.放电时溶液中的阴离子OH-向负极移动. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84725[举报]
燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质溶液通常是KOH溶液。下列关于甲烷燃料电池的说法错误的是
A.负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O
B.正极反应式为O2 + 2H2O + 4e-=== 4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
查看习题详情和答案>>
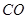 、
、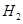 、
、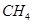 )等跟
)等跟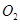 (或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如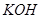 )溶液,下列关于甲烷燃料电池的说法中不正确的是:
)溶液,下列关于甲烷燃料电池的说法中不正确的是: