网址:http://m.1010jiajiao.com/timu3_id_84716[举报]
|
吸热反应N2(g)+O2(g) | |
| [ ] | |
A. |
此反应的初始状态为化学平衡状态 |
B. |
此反应的初始状态为非化学平衡状态,反应将正向进行 |
C. |
此反应的初始状态为非化学平衡状态,反应将逆向进行 |
D. |
无法判断 |
吸热反应N2(g)+O2(g)![]() 2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10 L密闭容器内放入3×10-3 mol NO、2.50×10-1 mol N2和4.00×10-2 mol O2,通过计算回答:
2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10 L密闭容器内放入3×10-3 mol NO、2.50×10-1 mol N2和4.00×10-2 mol O2,通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行?
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液的pH________(填大于、小于或等于)Na2A溶液的pH.
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①降低温度时,Ksp________(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)________(填“增大”、“减小”或“不变”).
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:
Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为:________.
(2)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(3)若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①温度降低时,Ksp________(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(4)欲使10 L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)①温度降低时,K sp________(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:
Cr2O72-(4)欲使10 L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38Ksp[Cr(OH)3]=6.0×10-31)
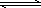 2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10 L密闭容器内放入2.94×10-3 mol NO、2.50×10-1 mol N2和4.00×10-2 mol O2,则下列说法正确的是
2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10 L密闭容器内放入2.94×10-3 mol NO、2.50×10-1 mol N2和4.00×10-2 mol O2,则下列说法正确的是