摘要:6.控制适合的条件.将反应2Fe3++2I-2Fe2++I2设计成如下所示的原电池.下列判断不正确的是 ( ) A.反应开始时.乙中石墨电极上发生氧化反应 B.反应开始时.甲中石墨电极上Fe3+被还原 C.电流计读数为零时.反应达到化学平衡状态 D.电流计读数为零后.在甲中溶入FeCl2固体.乙中的石墨电极为负极 解析:由反应2Fe3++2I-2Fe2++I2可知.反应开始时甲中Fe3+发生还原反应.乙中I-发生氧化反应,电流计读数为零.说明单位时间内由甲流向乙的电子数与由乙流向甲的电子数相等.生成Fe3+的物质的量与消耗的Fe3+相等.则反应达到了平衡状态.此时在甲中溶入FeCl2固体.则平衡向逆反应方向移动.乙中I2发生还原反应.则乙中石墨电极为正极,故选D. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84511[举报]
控制适合的条件,将反应2 Fe 3+ +2I-
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是

A. 反应开始时,乙中石墨电极上发生氧化反应

 B. 电流计读数为零后,在甲中溶入FeCl2固体,
B. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
C. 反应开始时,甲中石墨电极上Fe3+被还原
D. 电流计读数为零时,反应达到化学平衡状态
查看习题详情和答案>>
控制适合的条件,将反应2 Fe 3+ +2I- ![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
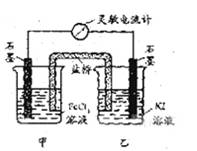
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
C. 反应开始时,甲中石墨电极上Fe3+被还原
D. 电流计读数为零时,反应达到化学平衡状态
查看习题详情和答案>>控制适合的条件,将反应2 Fe 3+ +2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
C. 反应开始时,甲中石墨电极上Fe3+被还原
D. 电流计读数为零时,反应达到化学平衡状态
查看习题详情和答案>>
 I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
 B 电流计读数为零时,反应达到化学平衡状态
B 电流计读数为零时,反应达到化学平衡状态 I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
 A 反应从正向开始时,乙中石墨电极上发生氧化反应
A 反应从正向开始时,乙中石墨电极上发生氧化反应