摘要:10.早在1807年化学家戴维用电解熔融氢氧化钠的方法制得钠:4NaOH4Na+O2↑+2H2O,后来盖-吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOHFe3O4+2H2↑+4Na↑.下列有关说法正确的是 ( ) A.电解熔融氢氧化钠制钠.阳极发生的电极反应为:2OH--2e-===H2↑+O2↑ B.盖-吕萨克法制钠原理是利用铁的还原性比钠强 C.若戴维法与盖-吕萨克法制得等量的钠.则两反应中转移的电子总数也相同 D.目前工业上常用电解熔融氯化钠法制钠.电解时可用石墨作阳极.铁作阴极 解析:电解熔融NaOH时.阳极OH-放电生成O2和H2O.A不正确.钠的还原性强于铁.B不正确.C项.假设分别制得4 mol钠.则转移电子数分别为4 mol.8 mol.C不正确. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84501[举报]
 4Na+O2↑+2H2O;后来盖—吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖—吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH(熔融)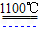 Fe3O4+2H2↑+4Na↑.下列有关说法正确的是
Fe3O4+2H2↑+4Na↑.下列有关说法正确的是