摘要:1.下列推断正确的是( ) A.SiO2是酸性氧化物.能与NaOH溶液反应 B.Na2O.Na2O2组成元素相同.与CO2反应产物也相同 C.CO.NO.NO2都是大气污染气体.在空气中都能稳定存在 D.新制氯水显酸性.向其中滴加少量紫色石蕊试液.充分振荡后溶液呈红色 解析:SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH===Na2SiO3+H2O.符合酸性氧化物的定义.A选项正确,Na2O与CO2反应生成Na2CO3.Na2O2与CO2反应的产物为Na2CO3和O2.B选项错误,NO在常温下与空气中的O2迅速反应生成NO2.化学方程式为2NO+O2===2NO2.C选项错误,新制氯水中存在H+和HClO.具有酸性和漂白性.所以滴加紫色石蕊试液振荡.溶液先变红后褪色.D选项错误. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_84434[举报]
2 mol A与2 mol B混合于2 L 的密闭容器中,发生如下反应:2A(g)+3B(g) 
2C (g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.25 mol·L-1·s-1 B.z=3
C.B的转化率为25% D.C的体积分数为28.6%
查看习题详情和答案>>2mol A与2mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)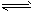 2C(g)+zD(g)。若2s后A的转化率为50%,测得v(D)=0. 25mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g)。若2s后A的转化率为50%,测得v(D)=0. 25mol·L-1·s-1,下列推断正确的是
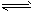 2C(g)+zD(g)。若2s后A的转化率为50%,测得v(D)=0. 25mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g)。若2s后A的转化率为50%,测得v(D)=0. 25mol·L-1·s-1,下列推断正确的是[ ]
A.v(C) =v(D)=0. 25mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C的体积分数为28. 6%
查看习题详情和答案>>
B.z=3
C.B的转化率为25%
D.C的体积分数为28. 6%
依据元素周期表及元素周期律,下列推断正确的是
A.P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.若M+和R2-的核外电子层结构相同,则原子序数R>M
D.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
查看习题详情和答案>>恒温下,容积均为2L的密闭容器M、N中,分别有以下两种起始投料建立的可逆反应
3A(g)+2B(g)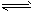 2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、
2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、
ymolD,达到平衡时c(A) =0. 6mol/L。下列推断正确的是
3A(g)+2B(g)
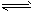 2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、
2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、ymolD,达到平衡时c(A) =0. 6mol/L。下列推断正确的是
[ ]
A.x=2
B.平衡时,M中c(A)<0.6mol/L
C.y>0.8
D.v<0.8
查看习题详情和答案>>
B.平衡时,M中c(A)<0.6mol/L
C.y>0.8
D.v<0.8
已知25℃时有关弱酸的电离平衡常数如下表:
|
弱酸化学式 |
HX |
HY |
H2CO3 |
|
电离平衡常数 |
7.8╳10-9 |
3.7╳10-15 |
K1=4.3╳10-7 K2=5.6╳10-11 |
下列推断正确的是
A.这两种弱酸的酸性HX>HY
B.相同条件下溶液的碱性NaX>Na2CO3>NaY>NaHCO3
C. 结合H+的能力:CO32->Y->X->HCO3-
D.HX和HY酸性相同,都比H2CO3弱
查看习题详情和答案>>