摘要:12.(2009·江苏启东.如东联考)有A.B.C.D.E.F六种短周期元素.原子序数依次增大.已知A的一种核素的原子核为质子.B原子的最外层电子数是次外层电子数的2倍.B原子的最外层电子数是D.E原子最外层电子数之和.C原子的最外层电子数是D.F原子最外层电子数之和.下列推论正确的是 ( ) A.A.B两元素能形成多种化合物 B.D.E两元素的最高价氧化物对应的水化物均为强碱 C.C的气态氢化物的稳定性一定大于F的气态氢化物 D.C.F两种元素可能形成原子晶体型的新型无机非金属材料 解析:由题知A为氢元素.B为碳元素.D.E最外层电子数之和为4.则为1.3或2.2.由于均为短周期元素.且原子序数依次增大.则为1.3.D为钠.E为铝.C原子最外层电子数是D.F最外层电子数之和.若C最外层电子数为5.则F为4.此时.C为氮元素.F为硅元素.若C最外层电子数为6.则C为氧元素.F为磷元素.若C最外层电子数为7.则C为氟元素.F为硫元素.若C为氖.则无气态氢化物.C不正确.若C为氮.F为硅时.则可形成Si3N4新型无机非金属材料. 答案:AD
网址:http://m.1010jiajiao.com/timu3_id_84029[举报]
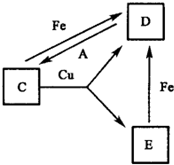 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:①A常温下为黄绿色气体;
②B为淡黄色固体,溶于水同时有无色气体放出;
③C、D所含元素相同,溶液中C、D、E能发生右图所示转化;
④F是一种钾盐,受热时也会产生②中的无色气体,分解剩余固体与浓盐酸共热可生成气体A.
请回答下列问题:
(1)A的电子式为
(2)②中反应的化学方程式为
(3)C、D溶液的颜色依次为
(4)F的化学式是
有A、B、C、D、E、F六种有机物,在一定条件下可发生如右图所示的转化关系.A可作为衡量一个国家石油化工发展水平的标志之一,A可氧化生成D,D与新制的Cu(OH)2悬浊液共热可生成一种砖红色沉淀,B与NaOH溶液共热得到C和无机盐NaX,在经硝酸酸化的NaX溶液中加入硝酸银溶液会产生淡黄色沉淀,燃烧等物质的量的这六种有机物,F燃烧产生的CO2的物质的量是其他有机物的2倍,只有C与E能与钠反应产生气泡.试推断:

(1)各物质的结构简式:
A
(2)C在浓硫酸作用下加热到170℃可制取A,写出该反应的化学方程式:
(3)下列反应中属于氧化反应的是(填写序号)
①D→E ②D→C ③E→F ④C→D ⑤F→E.
查看习题详情和答案>>

(1)各物质的结构简式:
A
CH2=CH2
CH2=CH2
;BCH3CH2Br
CH3CH2Br
;CCH3CH2OH
CH3CH2OH
;DCH3CHO
CH3CHO
;ECH3COOH
CH3COOH
;FCH3COOCH2CH3
CH3COOCH2CH3
.(2)C在浓硫酸作用下加热到170℃可制取A,写出该反应的化学方程式:
C2H5OH
CH2=CH2+H2O
| 浓H2SO4 |
| △ |
C2H5OH
CH2=CH2+H2O
.| 浓H2SO4 |
| △ |
(3)下列反应中属于氧化反应的是(填写序号)
①④
①④
.①D→E ②D→C ③E→F ④C→D ⑤F→E.
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂.E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同.现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾
②将A为分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色,无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶.
根据上述实验信息,下列说法错误的是( )
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾
②将A为分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色,无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶.
根据上述实验信息,下列说法错误的是( )
| A、B不可能NaHCO3溶液 | B、F为AgNO3溶液 | C、D不可能是镁或铝的盐酸盐 | D、A为氨水,E为硫酸 |
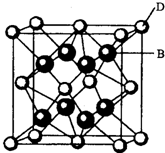 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如图所示.
请回答下列问题.
(1)E元素原子基态时的电子排布式为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是
(4)从图中可以看出,D跟B形成的离子化合物的化学式为
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂.纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同.现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶;
④将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出.
根据上述实验信息,请回答下列问题:
(1)A溶液中存在的化学平衡为
(2)C溶液中溶质的化学式为
(3)不能确定的溶液是(写出溶液标号与可能相应溶质的化学式)
查看习题详情和答案>>
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶;
④将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出.
根据上述实验信息,请回答下列问题:
(1)A溶液中存在的化学平衡为
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
;A与D溶液混合发生反应的离子方程式为3NH3?H2O+Al3+═Al(OH)3↓+3NH4+(或2NH3?H2O+Mg2+═Mg(OH)2↓+2NH4+)
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+(或2NH3?H2O+Mg2+═Mg(OH)2↓+2NH4+)
.(2)C溶液中溶质的化学式为
BaCl2
BaCl2
;F溶液中溶质的化学式为AgNO3
AgNO3
.(3)不能确定的溶液是(写出溶液标号与可能相应溶质的化学式)
B:Na2CO3或K2CO3,D:Al2(SO4)3或MgSO4
B:Na2CO3或K2CO3,D:Al2(SO4)3或MgSO4
,进一步鉴别的方法是用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液;
取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.
取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.
用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液;
取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.
.取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.