网址:http://m.1010jiajiao.com/timu3_id_83822[举报]
溴及其化合物在人类生产生活中有广泛应用。大量的溴用于制造感光材料和染料,化学试剂和医学药物等,家用药箱中的必备药品红汞就是溴汞化合物。
茫茫大海是溴的“故乡”,早在19世纪初,法国化学家就发明了提取溴的空气吹出法工艺,这个方法也是目前工业规模海水提滚的成熟方法。其工艺流程如下:
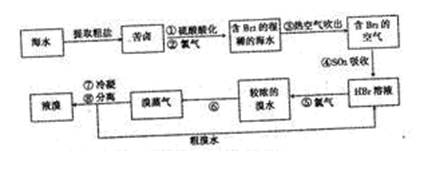
(1)步骤③中通入然空气而不是直接通入空气的原因是 。
(2)步骤④的化学反应方程式: 。
(3)步骤⑥的操作方法是 (填操作名称)。
(4)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
(5)将步骤③分离出的溴用碳酸钠吸收,得到溴化钠和溴酸钠的混合物,再酸化、蒸馏,就可得较纯的溴,过程中有两步主要反应,请写出第二步反应的离子方程式:
a.3Br2+3CO32-=5Br-+B2O3+3CO2↑
b.
现有1t含纯碱晶体(Na2CO3·10H2O)28.6%的工业废渣,可用于溴的生产。理论上可得到溴 kg。
查看习题详情和答案>>
溴及其化合物在人类生产生活中有广泛应用。大量的溴用于制造感光材料和染料,化学试剂和医学药物等,家用药箱中的必备药品红汞就是溴汞化合物。
茫茫大海是溴的“故乡”,早在19世纪初,法国化学家就发明了提取溴的空气吹出法工艺,这个方法也是目前工业规模海水提滚的成熟方法。其工艺流程如下:

(1)步骤③中通入然空气而不是直接通入空气的原因是 。
(2)步骤④的化学反应方程式: 。
(3)步骤⑥的操作方法是 (填操作名称)。
(4)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
(5)将步骤③分离出的溴用碳酸钠吸收,得到溴化钠和溴酸钠的混合物,再酸化、蒸馏,就可得较纯的溴,过程中有两步主要反应,请写出第二步反应的离子方程式:
a.3Br2+3CO32-=5Br-+B2O3+3CO2↑
b.
现有1t含纯碱晶体(Na2CO3·10H2O)28.6%的工业废渣,可用于溴的生产。理论上可得到溴 kg。
查看习题详情和答案>>
溴及其化合物在人类生产生活中有广泛应用。大量的溴用于制造感光材料和染料,化学试剂和医学药物等,家用药箱中的必备药品红汞就是溴汞化合物。
茫茫大海是溴的“故乡”,早在19世纪初,法国化学家就发明了提取溴的空气吹出法工艺,这个方法也是目前工业规模海水提滚的成熟方法。其工艺流程如下:

(1)步骤③中通入然空气而不是直接通入空气的原因是 。
(2)步骤④的化学反应方程式: 。
(3)步骤⑥的操作方法是 (填操作名称)。
(4)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
(5)将步骤③分离出的溴用碳酸钠吸收,得到溴化钠和溴酸钠的混合物,再酸化、蒸馏,就可得较纯的溴,过程中有两步主要反应,请写出第二步反应的离子方程式:
a.3Br2+3CO32-=5Br-+B2O3+3CO2↑
b.
现有1t含纯碱晶体(Na2CO3·10H2O)28.6%的工业废渣,可用于溴的生产。理论上可得到溴 kg。
查看习题详情和答案>>
②步骤Ⅱ中调节溶液pH为3.5的目的是__________。
③流程中用到的几种物质分别为:X________;Y________;Z________;M________。