网址:http://m.1010jiajiao.com/timu3_id_83789[举报]
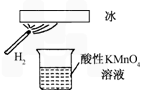
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L.
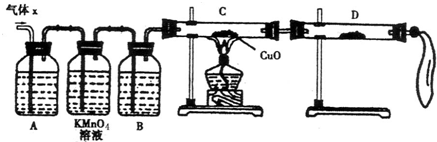
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究.
①A中加入的试剂可能是
②证实气体X中混有杂质气体,D中应选择的试剂是
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为:
某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
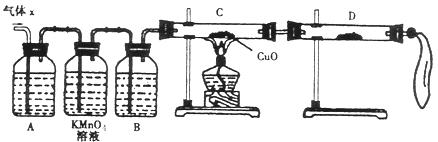
(1)该化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如图所示实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列 。
A.反应后剩余锌的质量为17.5g B.收集到气体的质量为25.8g
C.浓硫酸的物质的量浓度为18.0mol/L
查看习题详情和答案>>(14分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是: 。
(2)简述强调“测得的pH小于7”的理由: 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。
由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
编号 | 盐酸 | NaOH溶液 | △t/℃ |
1 | 3.65 | 2.00 | 3.5 |
2 | 3.65 | 4.00 | x |
3 | 7.30 | 8.00 | 14 |

(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据 (填实验现象)判断NaOH溶液与稀盐酸发生了中和反应。
查看习题详情和答案>>
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是: .
(2)简述强调“测得的pH小于7”的理由: .
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是 .实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色.请用离子方程式解释这一现象产生的原因: .
由此说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大: .
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验.则该同学根据 判断NaOH溶液与稀盐酸发生了中和反应.
 查看习题详情和答案>>
查看习题详情和答案>>