网址:http://m.1010jiajiao.com/timu3_id_83622[举报]

(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________.
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________.
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。
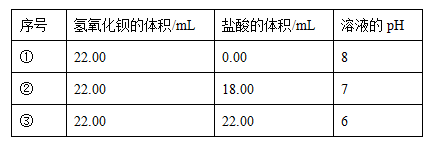
(12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=________。
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。
查看习题详情和答案>>
(12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。 查看习题详情和答案>>
(12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=________。
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。
查看习题详情和答案>>