网址:http://m.1010jiajiao.com/timu3_id_83527[举报]
某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
① 用直流电电解氯化铜溶液,所用仪器如图:
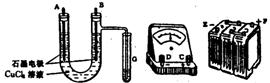
②在电流强度为I安培,通电时间为ts钟后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接 ,C接 , 接F。
实验线路中的电流方向为 → → →C→ → 。
(2)写出B电极上发生反应的离子方程式 ,G试管中淀粉KI溶液变化的现象为 ,相应的离子方程式是 。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极的质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿佛加德罗常数的计算表达式:NA 。
查看习题详情和答案>>某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如下图。
②强度为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。
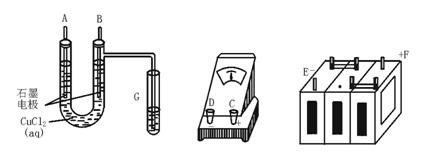
试回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同)
E接____________,C接____________,____________接F。
实验线路中的电流方向为________→_______→________→C→________→________
(2)写出B电极上发生反应的离子方程式____________,G试管中淀粉KI溶液变化的现象为____________,相应的离子方程式是____________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是____________。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19 C。试列出阿伏加德罗常数的计算表达式:NA=____________。
查看习题详情和答案>>(10分)某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19C.试列出阿伏伽德罗常数的计算表达式:NA=________.
(10分)某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
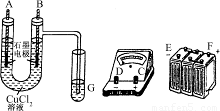
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19C.试列出阿伏伽德罗常数的计算表达式:NA=________.
查看习题详情和答案>>
①用直流电电解氯化铜溶液,所用仪器如图:

(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极
④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19 C.试列出阿伏伽德罗常数的计算表达式:NA=_____.