摘要:4.在下列操作过程中.发生的反应能用离子方程式Al3++3AlO+6H2O===4Al(OH)3↓表示的是 ( ) A.向铝盐溶液中不断滴加NaOH溶液 B.向NaOH溶液中不断滴加铝盐溶液 C.向铝盐溶液中不断滴加小苏打溶液 D.向铝盐溶液中不断增加NaAlO2溶液 解析:由Al3++3AlO+6H2O===4Al(OH)3↓.可知该反应由可溶性Al3+和AlO盐反应而来.A.B是由Al3+和OH-反应.C是Al3+与HCO的双水解反应. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_83467[举报]
在下列操作过程中,发生的反应能用离子方程式Al3++3AlO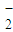 +6H2O═4Al(OH)3↓表示的是( )
+6H2O═4Al(OH)3↓表示的是( )
A.向铝盐溶液中不断滴加NaOH溶液
B.向氨水中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液
D.向铝盐溶液中不断滴加NaAlO2溶液
查看习题详情和答案>>
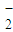 +6H2O═4Al(OH)3↓表示的是( )
+6H2O═4Al(OH)3↓表示的是( )A.向铝盐溶液中不断滴加NaOH溶液
B.向氨水中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液
D.向铝盐溶液中不断滴加NaAlO2溶液
查看习题详情和答案>>
在下列操作过程中,发生的反应能用离子方程式Al3++3AlO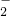 +6H2O=4Al(OH)3↓表示的是
+6H2O=4Al(OH)3↓表示的是
- A.向铝盐溶液中不断滴加NaOH溶液
- B.向氨水中不断滴加铝盐溶液
- C.向铝盐溶液中不断滴加小苏打溶液
- D.向铝盐溶液中不断滴加NaAlO2溶液
在下列操作过程中,发生的反应能用离子方程式Al3++3AlO2-+6H2O===4Al(OH)3↓表示的是
[ ]
A.向铝盐溶液中不断滴加NaOH溶液
B.向NaOH溶液中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液
D.向铝盐溶液中不断增加NaAlO2溶液
查看习题详情和答案>>
B.向NaOH溶液中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液
D.向铝盐溶液中不断增加NaAlO2溶液
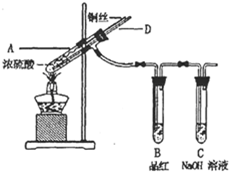 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.【实验1】铜与浓硫酸反应,实验装置如图所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.装置C中发生反应的离子方程式为
| ||
SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
.(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是
试管A中气体压强减小,空气从D导管进入试管A中
试管A中气体压强减小,空气从D导管进入试管A中
.(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是
从D管口向A中通入空气(鼓气)
从D管口向A中通入空气(鼓气)
.【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行如图的实验:
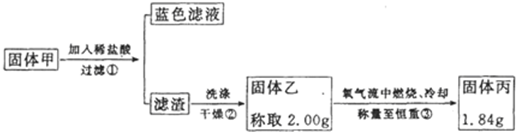
(4)②中检验滤渣是否洗涤干净的实验方法是
取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净
取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净
.(5)③中在煅烧过程中一定发生的反应的化学方程式为
2CuS+3O2
2CuO+2SO2
| ||
2CuS+3O2
2CuO+2SO2
.
| ||
(6)下列对于固体甲的成分的判断中,不正确的是(填字母选项)
BCD
BCD
.A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S.