网址:http://m.1010jiajiao.com/timu3_id_83140[举报]
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)

②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:____________________________________________________________________________________________________________________。
(2)373 K时,H2PO3-与OH-发生如下反应:H2PO3-+OH-
 HPO32-+ H2O 反应结果如下表所示
HPO32-+ H2O 反应结果如下表所示 
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20 mol/L,c(OH-)的起始浓度为1.50 mol/L,则反应速率v=
________。
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4
 Na2SO4+S↓+SO2↑+H2O) 为0.20 mol/L, c(OH-)的起始浓度为1.50 mol/L,则反应速率v=____________.
Na2SO4+S↓+SO2↑+H2O) 为0.20 mol/L, c(OH-)的起始浓度为1.50 mol/L,则反应速率v=____________. 
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:___________________________________________________.
(2)373 K时,H2PO3-与OH-发生如下反应: H2PO3-+OH-
 HPO32-+H2O 反应结果如下表所示:
HPO32-+H2O 反应结果如下表所示: 
①k=________, m=________, n=________.
②若c(H2PO4-)的起始浓度为0.20 mol/L, c(OH-)的起始浓度为1.50 mol/L,则反应速率v=____________.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
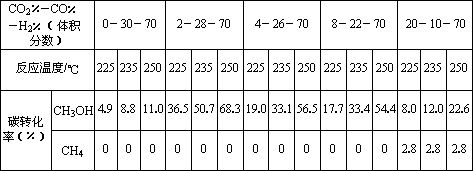
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
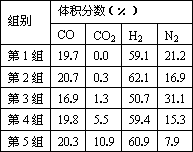
进行该验证实验时,控制不变的因素有________、________、________等.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g)ΔH<0.
CH3OH(g)ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
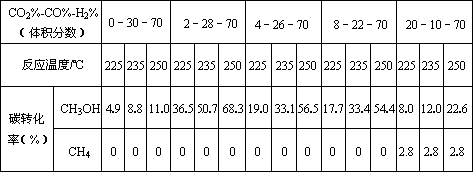
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率__________.
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
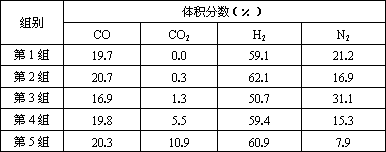
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。
CH3OH(g) ΔH < 0。
原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%- H2% (体积分数) | 03070 | 22870 | 42670 | 82270 | 201070 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转 化率 (%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(1)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:___________________________________________________________
____________________________________________________________________。
为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
| 组别 | 体积分数(%) | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、__________
__________________________________等。
查看习题详情和答案>>