网址:http://m.1010jiajiao.com/timu3_id_82940[举报]
| 化学反应 | 平衡常数 | 温度 | 973K | 1173K | ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 | ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 | ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? | |
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
(3)根据反应①与②可推导出K1,K2与K3之间的关系,则K3=
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中C0的浓度
II.氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途.
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为
(3)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓 度关系正确的是
A.c(Na+ )+c(H+ )=c(0H-)+c(Cl-)
B.c(Na+ )=c(ClO- )+c(Cl-)
C.c(Cl-)=c(ClO?)+c(HClO)
D.c(Na+)=2c(ClO- )+c(HClO)
(4)若用钢铁(含Fe、C)制品盛装84消毒液,则易发生电化学腐蚀,钢铁 制品表面生成红褐色沉淀,且84消毒液会失去杀菌消毒的功效.正极反应式为
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0、86×10-4 | 2、6×10-4 | 64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
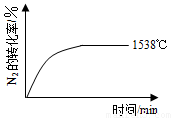
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H22NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(4)合成氨的反应N2(g)+3H2(g)2NH3(g) △H =-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
查看习题详情和答案>>
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2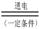 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g)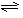 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
查看习题详情和答案>>
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两电极板,通过导线与直流电源相连。回答以下问题:
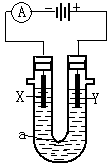
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X的电极材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
查看习题详情和答案>>自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g) ΔH=a kJ·mol-1的平衡常数K如下表:
2NO(g) ΔH=a kJ·mol-1的平衡常数K如下表:
![]()
①该反应的ΔH________0(填“>”、“=”或“<”).
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃时N2的转化率随时间变化的示意图.
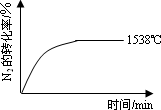
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热ΔH=________.(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2 2NH3.则在电解法合成氨的过程中,应将H2不断地通入________极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为________.
2NH3.则在电解法合成氨的过程中,应将H2不断地通入________极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为________.
(4)合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填字母代号).
2NH3(g) ΔH=-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填字母代号).
a、升高温度
b、加入催化剂
c、增加H2的浓度
d、增加N2的浓度
e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”),可推断a________0.01(填大于、等于或小于).
