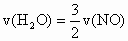摘要:19.已知反应:.在含有amolFeBr2的溶液中通人bmolCl2时.如的值不同时会发生不同的反应.请按要求写出离子方程式: (1) ≥2时.离子方程式为 , (2)≤专时.离子方程式为 , (3) =1.离子方程式为 . 答案:
网址:http://m.1010jiajiao.com/timu3_id_82928[举报]
(2013?闵行区二模)开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一.其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品.
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
4N2+6H2O 6NO2+8NH3
7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
②尾气中NO的含量为
③要处理5m3的尾气,需要氨氧混合气的体积为
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,则x=
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4?2H2O).已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗).
查看习题详情和答案>>
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
19.37
19.37
(精确到0.01).②尾气中NO的含量为
1800
1800
mg/m3.③要处理5m3的尾气,需要氨氧混合气的体积为
10.64
10.64
L.(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
8
8
mol/L,体积为62.5
62.5
mL.②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,则x=
1.8
1.8
.(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4?2H2O).已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗).
开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一.其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品.
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3 7N2+12H2O
7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为______(精确到0.01).
②尾气中NO的含量为______mg/m3.
③要处理5m3的尾气,需要氨氧混合气的体积为______L.
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为______mol/L,体积为______mL.
②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,则x=______.
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4?2H2O).已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗).
查看习题详情和答案>>
已知反应:
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O
2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O
2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O
某样品A由①Na2SO4②NaCl ③Na2S ④Na2SO3⑤Na2S2O3 五种物质中的三种混合而成.取一定量的样品A,投入到0.300L 1.00mol/L 的稀盐酸中,充分反应后,滤去不溶物B,将所得的溶液稀释到1.00L,测得其pH=1,蒸干此溶液,最终得到纯净物C.结合所学知识,解答下列问题:
(1)样品A中一定没有的物质
(2)若测得C的质量为W克,且样品A中一定含有NaCl,则W值的范围
(3)若样品A与盐酸完全反应,同时在标准状况下还收集到224ml的H2S气体(设产生的气体全部逸出),则样品A中的Na2S的质量为
查看习题详情和答案>>
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O
2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O
2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O
某样品A由①Na2SO4②NaCl ③Na2S ④Na2SO3⑤Na2S2O3 五种物质中的三种混合而成.取一定量的样品A,投入到0.300L 1.00mol/L 的稀盐酸中,充分反应后,滤去不溶物B,将所得的溶液稀释到1.00L,测得其pH=1,蒸干此溶液,最终得到纯净物C.结合所学知识,解答下列问题:
(1)样品A中一定没有的物质
①
①
(填序号)(2)若测得C的质量为W克,且样品A中一定含有NaCl,则W值的范围
W>11.7
W>11.7
(3)若样品A与盐酸完全反应,同时在标准状况下还收集到224ml的H2S气体(设产生的气体全部逸出),则样品A中的Na2S的质量为
5.46
5.46
g.饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能.为了降低饮用水中NO3-的浓度,某兴趣小组提出如图甲方案:

请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为
(2)该方案中选用熟石灰调节pH,理由是
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为
(4)饮用水中的NO3- 主要来自于NH4+.已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图乙:试写出1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是
查看习题详情和答案>>

请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为
10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-
10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-
.(2)该方案中选用熟石灰调节pH,理由是
来源丰富、价格便宜
来源丰富、价格便宜
、引入的Ca2+对人体无害
引入的Ca2+对人体无害
,在调节pH时,若pH过大或过小都会造成Al
Al
的利用率降低.(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为
5H2+2NO3-
N2+4H2O+2OH-
| ||
5H2+2NO3-
N2+4H2O+2OH-
.
| ||
(4)饮用水中的NO3- 主要来自于NH4+.已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图乙:试写出1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是
NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ?mol-1
NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ?mol-1
.

 反应中,在某一时刻各物质的反应速率分别为
反应中,在某一时刻各物质的反应速率分别为 ,
, ,
, ,
,
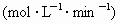 ,则下列关系式不正确的是
,则下列关系式不正确的是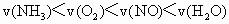
 ,
,
 )
) ,
,