摘要:6.有X.Y.Z三种溶液.向Na2CO3溶液中加入X.产生白色沉淀.加入过量的Y.沉淀溶解并产生气体.最后加入Z.又生成白色沉淀.则三种溶液的正确组合是 ( ) 答案: 6.AD
网址:http://m.1010jiajiao.com/timu3_id_82894[举报]
X、Y、Z、W四种化合物均由1~18号之间的元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去).请回答:
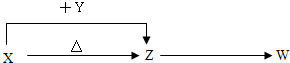
(1)W的化学式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体.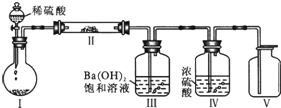
①写出装置Ⅰ中反应的化学方程式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下也可制备得装置Ⅴ中气体,该化合物的化学式是
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
查看习题详情和答案>>

(1)W的化学式是
CO2
CO2
.(2)X与Y在溶液中反应的离子方程式是
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体.

①写出装置Ⅰ中反应的化学方程式是
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O
;装置Ⅱ中物质的化学式是Na2O2
Na2O2
.②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下也可制备得装置Ⅴ中气体,该化合物的化学式是
H2O2
H2O2
,试指出装置I中圆底烧瓶中所盛装的药品是MnO2
MnO2
.(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
2Na2CO3+C12+H2O=NaC1O+NaCl+2NaHCO3
2Na2CO3+C12+H2O=NaC1O+NaCl+2NaHCO3
.(1)有A、B、C、D四种未知溶液,已知它们分别是NaHSO4、NaHCO3、BaCl2、Na2SO4四种溶液中的一种,现进行如下表所示的实验,根据现象,试确定B、C、D各是什么物质.
(2)现有下列四组溶液,每组包括三种溶液并按X、Y、Z的顺序排列:
请根据下列操作中所观察到的现象回答问题.
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了______组溶液.
③最后一步反应的离子方程式是______.
查看习题详情和答案>>
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是______ |
| A+C | 无明显现象 | C是______ |
| A+D | 产生白色沉淀 | D是______ |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了______组溶液.
③最后一步反应的离子方程式是______.
(2010?济南一模)下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
(4)I元素在周期表里的位置在第
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
查看习题详情和答案>>
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
氮
氮
(写出元素名称),请设计一个简单的实验证明这一结论取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
.或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(4)I元素在周期表里的位置在第
三
三
周期、第VIIA
VIIA
族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
13
13
.(KW=1.00×10-14)(1)有A、B、C、D四种未知溶液,已知它们分别是NaHSO4、NaHCO3、BaCl2、Na2SO4四种溶液中的一种,现进行如下表所示的实验,根据现象,试确定B、C、D各是什么物质.
(2)现有下列四组溶液,每组包括三种溶液并按X、Y、Z的顺序排列:
请根据下列操作中所观察到的现象回答问题.
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了
③最后一步反应的离子方程式是
查看习题详情和答案>>
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 NaHCO3 NaHCO3 |
| A+C | 无明显现象 | C是 Na2SO4 Na2SO4 |
| A+D | 产生白色沉淀 | D是 BaCl2 BaCl2 |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了
乙
乙
组溶液.③最后一步反应的离子方程式是
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
. W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成两种分子的离子方程式
NH4++OH-=NH3↑+H2O
NH4++OH-=NH3↑+H2O
.(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出该反应的化学方程式
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
| 浓H2SO4 |
| △ |
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
.| 浓H2SO4 |
| △ |
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
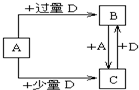
(4)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系.
①写出A与B反应生成C的化学方程式
CO2+C
2CO
| ||
CO2+C
2CO
;
| ||
②向50mL 4mol?L-1的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
n(Na2CO3):n(NaOH)=1:2
n(Na2CO3):n(NaOH)=1:2
.(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离子浓度由大到小的顺序为
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.