摘要:2.结合金属结构的特点.把握住“自由电子 这一关键.进而掌握金属晶体的特性.并能用之解释金属能导电.导热.有良好延展性的原因.潜能开发 [例1]下列叙述中正确的是 A.分子晶体中一定存在共价键 B.离子晶体中一定含金属元素 C.原子晶体一定不存在离子 D.晶体中有阳离子必含有阴离子 思路分析 A中由稀有气体分子构成的分子晶体中不含共价键,B中铵盐晶体虽然是离子晶体但不含金属元素,D在金属晶体中只有金属阳离子和自由电子.不含有阴离子,只有C正确.在原子晶体中原子与原子间只有共价键. [答案]C [例2]下列有关金属元素特征的叙述中正确的是 ( ) A.金属元素的原子只有还原性.离子只有氧化性 B.金属元素在化合物中一定显正价 C.金属元素在不同化合物中的化合价均不同 ] D.金属单质在常温下都是金属晶体 思维诊断 本题涉及几种晶体组成的粒子及化学键.并对各类晶体中存在的特例进行了考查.故我们对每个选项应逐一分析.找出可能出现的特例并加以排除.才能准确作答. A一些有可变化合价的元素如既有氧化性又有还原性,C金属在不同化合物中化合价可以相同,D金属汞在常温下是液态.不属于晶体.只有B正确. [答案]B 思维诊断 对于判断正误的习题一定要抓住每个选项中的关键词语.结合我们对化学概念的理解然后得出正确的结论. 知能达标训练
网址:http://m.1010jiajiao.com/timu3_id_82651[举报]
有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每条棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)________________。
(2)此化学式带何种电荷______________,如果Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为______________。
查看习题详情和答案>>有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示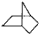
(1)写出其分子式__________,其分子式符合__________烃的通式,请你写出一种这种烃类物质的结构简式 _______________。
(2)当降冰片烷发生一氯取代时,能生成________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请你判断:降冰片烷属于________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体 e.能发生取代反应
查看习题详情和答案>>
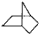
(1)写出其分子式__________,其分子式符合__________烃的通式,请你写出一种这种烃类物质的结构简式 _______________。
(2)当降冰片烷发生一氯取代时,能生成________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请你判断:降冰片烷属于________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体 e.能发生取代反应
2008年9月27日的下午,这是一个激动人心的时刻,“神舟七号”宇航员翟志刚走出飞船,实现了中国太空第一步。这是我国航天史上一座新的里程碑,标志着我国在攀登世界科技高峰的征程上,又迈出了具有重大历史意义的一步。
(1)钛作为一种重要的航天金属,在“神舟七号”飞船上得到广泛的应用,工业上可用钠、镁还原钛的卤化物来制备,写出镁还原四氯化钛的化学反应方程式____________________,该反应需在氩 气气氛中进行的原因是 ______________________________________。
(2)“神舟七号”飞船外壳使用了一种新型陶瓷结构材料,主要成分是氮化硅,是一种超硬物质,耐磨损、耐高温。依据氮、硅的原子结构的特点,推测氮化硅的化学式为__________。
(3)“尿不湿”最早应用于航天领域,至今已大量应用于民用领域,这种尿布表面涂有一种既能吸水又能保留水的物质。据你的推测,这种特殊物质的结构可能是________。
A.CH2=CHOOCCH3 B.CH2=CHF C.CH2=CHOH D.CCl2=CCl2
(4)肼(N2H4)是“神舟七号”飞船助推火箭发动机的燃料,反应时以N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol
①肼(N2H4)的电子式为____________。
②写出肼跟N2O4反应的热化学方程式 ___________________________________。
查看习题详情和答案>>
(1)钛作为一种重要的航天金属,在“神舟七号”飞船上得到广泛的应用,工业上可用钠、镁还原钛的卤化物来制备,写出镁还原四氯化钛的化学反应方程式____________________,该反应需在氩 气气氛中进行的原因是 ______________________________________。
(2)“神舟七号”飞船外壳使用了一种新型陶瓷结构材料,主要成分是氮化硅,是一种超硬物质,耐磨损、耐高温。依据氮、硅的原子结构的特点,推测氮化硅的化学式为__________。
(3)“尿不湿”最早应用于航天领域,至今已大量应用于民用领域,这种尿布表面涂有一种既能吸水又能保留水的物质。据你的推测,这种特殊物质的结构可能是________。
A.CH2=CHOOCCH3 B.CH2=CHF C.CH2=CHOH D.CCl2=CCl2
(4)肼(N2H4)是“神舟七号”飞船助推火箭发动机的燃料,反应时以N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol
①肼(N2H4)的电子式为____________。
②写出肼跟N2O4反应的热化学方程式 ___________________________________。
有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,C、H原子不表示出来,降冰片烷的立体结构如图所示。
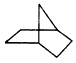
(1)写出其分子式___________,其分子式符合图中_________________烃的通式,请你写出一种这种烃类物质的结构简式____________________。
(2)当降冰片烷发生一氯取代时,能生成________________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请判断降冰片烷属于_______(选填序号,下同)。
a.环烷烃
b.炔烃
c.不饱和烃
d.芳香烃
(4)降冰片烷具有的性质是_____________。
a.能溶于水
b.能发生氧化反应
c.能发生加成反应
d.常温常压下为气体
e.能发生取代反应f密度小于水
查看习题详情和答案>>
(2)当降冰片烷发生一氯取代时,能生成________________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请判断降冰片烷属于_______(选填序号,下同)。
a.环烷烃
b.炔烃
c.不饱和烃
d.芳香烃
(4)降冰片烷具有的性质是_____________。
a.能溶于水
b.能发生氧化反应
c.能发生加成反应
d.常温常压下为气体
e.能发生取代反应f密度小于水