摘要:9.有四种金属分别用a.b.c.d表示.①这四种金属两两组成原电池时.a都是正极,②这四种金属可以 用盐酸把它们区分为a.d和b.c两组,③在用盐酸处理后的溶液中加入足量的强碱.可知b离子先沉 淀后溶解.且b.c同在第三周期.判断四种金属活泼性由强到弱的顺序为 ( ) A.c.b.d.a B.a.b.c.d C.a.c.b.d D.d.b.c.a 答案:9.A四种金属两两组成原电池a都为正极.所以a最不活泼.用盐酸分两组ab和bc.B离子为Al3+,c.b由在三周期.所以a>b>d>a
网址:http://m.1010jiajiao.com/timu3_id_82463[举报]
有四种金属分别用a、b、c、d表示.①这四种金属两两组成原电池时,a都是正极;②这四种金属可以 用盐酸把它们区分为a、d和b、c两组;③在用盐酸处理后的溶液中加入足量的强碱,可知b离子先沉淀后溶解,且b、c同在第三周期,判断四种金属活泼性由强到弱的顺序为( )
| A、c、b、d、a | B、a、b、c、d | C、a、c、b、d | D、d、b、c、a |
有四种金属分别用a、b、c、d表示。①这四种金属两两组成原电池时,a都是正极;②这四种金属可以用盐酸把它们区分为a、d和b、c两组;③在用盐酸处理后的溶液中加入足量的强碱,可知b离子先沉淀后溶解,且b、c同在第三周期,判断四种金属活泼性由强到弱的顺序为( )
A.c、b、d、a B.a、b、c、d C.a、c、b、d D.d、b、c、a
查看习题详情和答案>>A、B、C、D、E是五种常见的短周期主族元素,它们的原子序数依次增大,其中A与C、B与D分别同族,已知B、D两种元素原子核中质子数之和是A、C两种元素原子核中质子数的2倍,五种元素中只有一种为金属元素.请回答下列问题
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
(2)已知:2DB2+B2 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
查看习题详情和答案>>
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
H2O或H2O2
H2O或H2O2
、H2O2或H2O
H2O2或H2O
,写出其中一种物质使酸性KMnO4溶液褪色的离子反应方程式5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
.(2)已知:2DB2+B2
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热(30a+1.5b)
(30a+1.5b)
kJ(用a、b表示),我国工业生成DB2所用的原料是FeS2
FeS2
(填化学式)(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
.(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
溶液变为红色
溶液变为红色
.再通入等物质的量E2所观察的现象是溶液仍为红色
溶液仍为红色
.(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
H2+2OH--2e-→2H2O
H2+2OH--2e-→2H2O
.若以此电源进行铁片上镀铜,若两极质量差为6.4g时,理论上消耗标况下1.12
1.12
L的A单质.A、B、C、D四种气体都含有氮元素.已知A能在高温高压及催化剂作用下生成B;B的水溶液是一种弱碱,B经过铂金属的催化氧化得到C;C是双原子氧化物,在空气中继续氧化得到D;D是硝酸工业尾气中有害物质之一,能与水反应生成C和一元强酸E.按要求填空(1)写出下列反应的化学方程式:
①A→B:
②A→C:
③C→D:
④D通入水中:
(2)写出强酸E与铜片反应分别生成C或D的离子方程式:
①
②
(3)B能被Cl2氧化生成A和一种铵盐,写出反应化学方程式:
查看习题详情和答案>>
①A→B:
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.
| ||
| 高温高压 |
②A→C:
N2+O2
2NO
| ||
N2+O2
2NO
.
| ||
③C→D:
2NO+O2=2NO2
2NO+O2=2NO2
.④D通入水中:
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(2)写出强酸E与铜片反应分别生成C或D的离子方程式:
①
33Cu+2NO3-+8H+=Cu2++2NO↑+4H2O
33Cu+2NO3-+8H+=Cu2++2NO↑+4H2O
;②
Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
.(3)B能被Cl2氧化生成A和一种铵盐,写出反应化学方程式:
8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
.A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号
 ;
;
(3)C、D两元素形成的化合物的电子式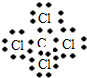
 .
.
(4)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.
查看习题详情和答案>>
(1)请写出A的元素符号
Mg
Mg
;(2)C的负一价阴离子的结构示意图

(3)C、D两元素形成的化合物的电子式


(4)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是
BC
BC
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.