摘要:2.(2010·山西师大附中1月考题)某同学为了逐一检验出溶液中是否含有Cl-.SO42-. OH-三种离子.设计以下四种实验方案.其中所加试剂及顺序正确的是( ) A.先加适量AgNO3溶液.过滤后向滤液中加适量的Ba(NO3)2溶液.再次过滤后向 滤液中加NH4NO3溶液并加热 B.先加适量NH4NO3溶液并加热.再向其中加适量的Ba(NO3)2溶液.过滤后向滤液 中加AgNO3溶液 C.先加适量Ba(NO3)2溶液.过滤后向滤液中加适量的AgNO3溶液.再次过滤后向 滤液中加NH4NO3溶液并加热 D.先加适量Ba(NO3)2溶液.过滤后向滤液中加适量的NH4Cl溶液并加热.最后加 入AgNO3溶液 解析:A项.先加入硝酸银溶液.三种离子均形成沉淀.不正确,B项.正确,C项. 第二步加入硝酸银溶液.则Cl-.OH-均会形成沉淀.不正确,D项.第二步加入 NH4Cl溶液会引入Cl-.故不能检验原来溶液中是否存在Cl-.不正确. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_81959[举报]
(2011?肇庆一模)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42-,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42-:
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设. 假设1:溶液中存在Fe3+、Fe2+; 假设2:溶液中存在
②设计方案、进行实验,验证假设.请写出实验步骤以及预期现象和结论(可不填满).限选实验试剂和仪器:试管、滴管、0.1moL?L-1KMnO4、0.1moL?L-1KSCN溶液、品红稀溶液.
查看习题详情和答案>>
(1)检验吸收液中的SO42-:
取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀
取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀
,证明Fe3+能够把H2SO3氧化成SO42-.(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+
2H2O
2H2O
═2FeCl2
2FeCl2
+H2SO4+2HCl
2HCl
,反应中的氧化产物是H2SO4
H2SO4
(写化学式).(3)吸收液中除了含有H+、Cl-、SO42-以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设. 假设1:溶液中存在Fe3+、Fe2+; 假设2:溶液中存在
Fe2+、H2SO3
Fe2+、H2SO3
②设计方案、进行实验,验证假设.请写出实验步骤以及预期现象和结论(可不填满).限选实验试剂和仪器:试管、滴管、0.1moL?L-1KMnO4、0.1moL?L-1KSCN溶液、品红稀溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 0.1mol/LKSN溶液向试管中滴入1~2滴 0.1mol/LKSN溶液向试管中滴入1~2滴 |
若出现血红色,则假设1成立;若未出现血红色,则假设1不成立(或假设2成立) |
| 步骤2: 另取1~3mL样品溶液于试管中 另取1~3mL样品溶液于试管中 滴入1~2mL品红稀溶液 滴入1~2mL品红稀溶液 |
若品红溶液红色褪色,则假设2成立 若品红溶液红色褪色,则假设2成立 若品红溶液不褪色,则假设2不成立 若品红溶液不褪色,则假设2不成立 |
| 步骤3: |
某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了下图所示实验装置.
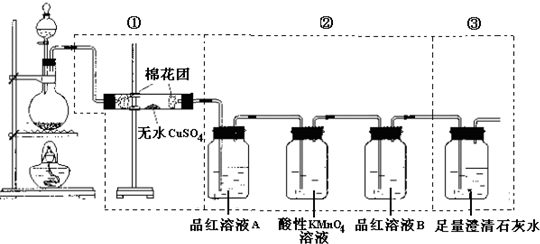
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
(2)①中无水硫酸铜的作用是
(3)②中酸性KMnO4溶液的作用是
(4)②中两次用到品红溶液,它们的作用分别是A
(5)③中出现的现象是
查看习题详情和答案>>

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2OC+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
. CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O(2)①中无水硫酸铜的作用是
检验反应生成的水蒸气
检验反应生成的水蒸气
.(3)②中酸性KMnO4溶液的作用是
除去混合气体中的SO2
除去混合气体中的SO2
.(4)②中两次用到品红溶液,它们的作用分别是A
检验生成的SO2气体
检验生成的SO2气体
、B检验SO2是否除尽
检验SO2是否除尽
.(5)③中出现的现象是
出现白色沉淀
出现白色沉淀
,发生反应的离子方程式是CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
.已知:粘土中含有铁元素.红砖常用作建筑材料,它是以粘土为原料,在高温下烧结而成,因其颜色呈红色或棕红色而得名.
(1)根据红砖的颜色,猜测其可能含有的红色成份是
(2)某同学为了检验猜测是否正确,设计了一个实验方案,请完成有关实验步骤并写出有关反应的离子方程式.
①用铁锤敲碎一小块红砖,在研钵中磨成粉末;
②取少量粉末用
③过滤;
④取少量溶液,滴加几滴KSCN溶液,观察到溶液颜色呈
查看习题详情和答案>>
(1)根据红砖的颜色,猜测其可能含有的红色成份是
Fe2O3
Fe2O3
.(2)某同学为了检验猜测是否正确,设计了一个实验方案,请完成有关实验步骤并写出有关反应的离子方程式.
①用铁锤敲碎一小块红砖,在研钵中磨成粉末;
②取少量粉末用
盐酸
盐酸
溶解;③过滤;
④取少量溶液,滴加几滴KSCN溶液,观察到溶液颜色呈
血红
血红
色.有关反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
;FeCl3+3KSCN=Fe(SCN)3+3KCl
FeCl3+3KSCN=Fe(SCN)3+3KCl
.(2009?徐汇区二模)某同学为了探究SO2与Na2O2的反应是否类似于CO2,设计反应装置见图.

(1)选择制取SO2的合适试剂
a.10%的H2SO4溶液 b.80%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
(2)装置C中NaOH溶液的作用是
(3)上述反应装置有些不足之处,为完善该装置,请从供选择的装置中选择需要的装置
(4)移开棉花,将带火星的木条放在C试管口,木条不复燃,该同学认为SO2与Na2O2的反应不同于CO2,请据此写出反应的化学方程式
(5)为检验是否有Na2SO4生成,设计如下方案

上述方案
(6)Na2O2反应完全后,为确定所得固体的组成,可进行如下操作:称取样品m g并溶于适量的水中,
a.加足量盐酸酸化的氯化钡溶液;b.加足量硫酸酸化的氯化钡溶液;c.过滤;d.洗涤; e.蒸发结晶.
查看习题详情和答案>>

(1)选择制取SO2的合适试剂
bc
bc
;a.10%的H2SO4溶液 b.80%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
(2)装置C中NaOH溶液的作用是
吸收多余的SO2,防止污染环境
吸收多余的SO2,防止污染环境
;(3)上述反应装置有些不足之处,为完善该装置,请从供选择的装置中选择需要的装置
②
②
(填编号),说明所选装置在整套装置中的位置将②加在A和B之间
将②加在A和B之间
;(4)移开棉花,将带火星的木条放在C试管口,木条不复燃,该同学认为SO2与Na2O2的反应不同于CO2,请据此写出反应的化学方程式
SO2+Na2O2=Na2SO4
SO2+Na2O2=Na2SO4
;(5)为检验是否有Na2SO4生成,设计如下方案

上述方案
不合理
不合理
(填“合理”、“不合理”),理由:如果固体中还有未反应的Na2O2,也能氧化亚硫酸钠为硫酸钠.
如果固体中还有未反应的Na2O2,也能氧化亚硫酸钠为硫酸钠.
;(6)Na2O2反应完全后,为确定所得固体的组成,可进行如下操作:称取样品m g并溶于适量的水中,
acd
acd
(选择下列操作的编号按操作顺序填入),烘干,称量,干燥沉淀质量为n g,计算含量.a.加足量盐酸酸化的氯化钡溶液;b.加足量硫酸酸化的氯化钡溶液;c.过滤;d.洗涤; e.蒸发结晶.
某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了下图所示实验装置.
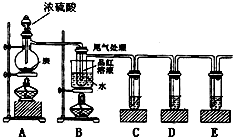
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
(2)若证明有水生成,需要在A、B之间加装盛有
(3)C中酸性KMnO4溶液的作用是
(4)D中用到品红溶液,它的作用是
(5)E中出现的现象是
(6)装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象
查看习题详情和答案>>

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(2)若证明有水生成,需要在A、B之间加装盛有
CuSO4
CuSO4
(填化学式)固体的干燥管.(3)C中酸性KMnO4溶液的作用是
除去混合气体中的SO2
除去混合气体中的SO2
.(4)D中用到品红溶液,它的作用是
检验SO2是否除尽
检验SO2是否除尽
.(5)E中出现的现象是
出现白色沉淀
出现白色沉淀
,发生反应的离子方程式是CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
.(6)装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象
品红褪色后,再点燃B处的酒精灯加热,若变红色,则证明SO2漂白有可逆性
品红褪色后,再点燃B处的酒精灯加热,若变红色,则证明SO2漂白有可逆性
.