摘要:饱和的氯化钠溶液--氢氧化钠.氢气.氯气 硫酸铜溶液--铜.氧气.硫酸 熔融的氧化铝--金属铝.氧气
网址:http://m.1010jiajiao.com/timu3_id_81821[举报]
氯化钠是从海水中提取出来的一种重要物质,除食用外,还是一种工业原料,如电解饱和氯化钠溶液可得到氯气、氢气和烧碱溶液(2NaCl+2H2O═2NaOH+Cl2↑+H2↑),下列说法正确的是( )
查看习题详情和答案>>
将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(1)利用上述原理所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选用的试剂是
(2)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为
查看习题详情和答案>>
(1)利用上述原理所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选用的试剂是
AgNO3溶液
AgNO3溶液
、稀HNO3
稀HNO3
,鉴定另一种杂质离子的方法是取少量固体与强碱溶液混合加热,生成的气体能使湿润的红色石蕊试纸变蓝
取少量固体与强碱溶液混合加热,生成的气体能使湿润的红色石蕊试纸变蓝
(2)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
查看习题详情和答案>>
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:
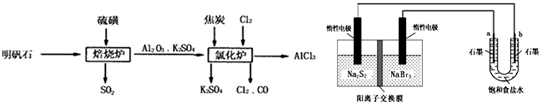
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
查看习题详情和答案>>

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
| ||
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______ 2NaOH+H2↑+Cl2↑ 查看习题详情和答案>>

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
 Na2S4+3NaBr
Na2S4+3NaBr①用惰性电极电解饱和食盐水的化学方程式为______ 2NaOH+H2↑+Cl2↑ 查看习题详情和答案>>