摘要:15.NH4Cl+ CH3COONa 总结--书写水解离子方程式的注意事项
网址:http://m.1010jiajiao.com/timu3_id_81795[举报]
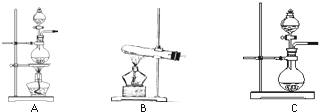 下表是实验室制备气体的有关内容:
下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C C |
| ② | 制氨气 | NH4Cl→NH3 | B B |
| ③ | 制氯气 | HCl→Cl2 | A或C A或C |
Cl2
Cl2
(填气体的化学式,下同.);从反应中有无电子转移的角度看,明显不同于其他气体的是NH3
NH3
,写出实验室制取该气体的化学方程式Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
.
| ||
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,则选择的试剂为
浓氨水和氢氧化钠(或生石灰等)
浓氨水和氢氧化钠(或生石灰等)
.(4)制备Cl2需用8mol?L-1的盐酸100mL,现用12mol?L-1的盐酸来配制.
①需要12mol?L-1的盐酸的体积为
66.7
66.7
mL(精确到0.1mL)②实验室提供有如下仪器,为完成配制需要选择的仪器为
ACFGH
ACFGH
.A. 100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.100mL烧杯 H.100mL容量瓶
③在容量瓶的使用方法中,下列操作中,不正确的是
BC
BC
(填写标号).A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(5)若用排空气法收集Cl2,画出收集装置图.
(一)请完成下列各空:
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(2)0.01mol?L-1CH3COOH溶液的pH
(3)0.1mol?L-1CH3COONa溶液的pH
(二)常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3?H2O,回答相关问题:
(1)上述溶液中,可发生水解的是
(2)在NaHCO3溶液中,离子浓度大小的关系正确的是
A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)=c(HCO3-)>c(H+)>c(OH-)
C、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
D、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积
(5)取10mL的③溶液加水稀释到500mL,则此溶液中由水电离出的c(H+)=
查看习题详情和答案>>
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
<
<
a+2(填“>”或“<”)(2)0.01mol?L-1CH3COOH溶液的pH
>
>
2(填“>”或“<”)(3)0.1mol?L-1CH3COONa溶液的pH
>
>
7(填“>”或“<”)(二)常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3?H2O,回答相关问题:
(1)上述溶液中,可发生水解的是
①②
①②
(填序号)(2)在NaHCO3溶液中,离子浓度大小的关系正确的是
CD
CD
(填字母)A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)=c(HCO3-)>c(H+)>c(OH-)
C、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
D、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值
增大
增大
(“增大”、“减小”或“不变”)(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积
小于
小于
④的体积(“大于”、“小于”或“等于”)(5)取10mL的③溶液加水稀释到500mL,则此溶液中由水电离出的c(H+)=
10-11
10-11
mol/L.(1)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K2CO3
(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHSO4、④CH3COOH、⑤NaOH、⑥Ba(OH)2、⑦NH4Cl,pH值由大到小的顺序为
查看习题详情和答案>>
K2CO3
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
,溶液呈碱
碱
性;Na2SO4不发生水解
不发生水解
,溶液呈中性
中性
性;CuCl2Cu2++2H2O?Cu(OH)2+2H+
Cu2++2H2O?Cu(OH)2+2H+
,溶液呈酸
酸
性.(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHSO4、④CH3COOH、⑤NaOH、⑥Ba(OH)2、⑦NH4Cl,pH值由大到小的顺序为
⑥>⑤>②>①>⑦>④>③
⑥>⑤>②>①>⑦>④>③
(填序号)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
(6)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
.
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H不改变
不改变
(填“增大”“减小”或“不改变”).(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1
.(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
1:10
1:10
.(6)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |