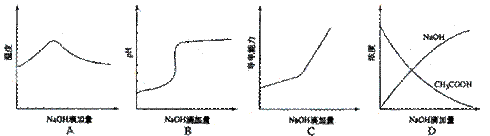
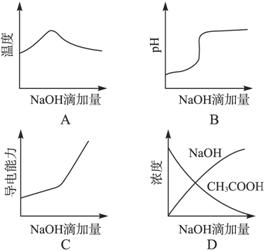
摘要:5.将氢氧化钠稀溶液滴加到醋酸稀溶液中.下列各图示意混合溶液有关 量或性质的变化趋势.其中错误的是 ( ) 解析:中和反应为放热反应.随着NaOH溶液加入.放出热量逐渐增多.溶液温度 升高.当反应完全时.再加NaOH溶液.溶液温度又逐渐降低.A正确,随着NaOH 溶液加入.溶液由酸性逐渐到中性.又到碱性.在溶液pH约为7时出现突变.当 醋酸完全反应后.再加NaOH溶液.pH增大缓慢.所以B正确,醋酸是弱酸.加 入NaOH溶液.生成强电解质醋酸钠.溶液导电能力增强.当CH3COOH反应完全后.再继续滴加NaOH.使得溶液中离子浓度又增大.从而导电能力增强.C正确,在加入NaOH溶液.而CH3COOH有剩余时.NaOH溶液浓度为零.所以D不正确. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_81687[举报]