摘要:若实数.互为相反数.则下列等式中恒成立的是( ) A. B. C. D.
网址:http://m.1010jiajiao.com/timu3_id_8168[举报]
(1)X3+的结构示意图为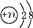 ,则X元素的核电荷数为
,则X元素的核电荷数为
(2)在化学反应aZn+bHNO3(稀)=cZn(NO3)2+dNO↑+eH2O中,若e的值为4,则d的值为
查看习题详情和答案>>
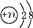 ,则X元素的核电荷数为
,则X元素的核电荷数为13
13
,该元素的氧化物的化学式为Al2O3
Al2O3
.(2)在化学反应aZn+bHNO3(稀)=cZn(NO3)2+dNO↑+eH2O中,若e的值为4,则d的值为
2
2
.元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.小明同学对它进行研究:
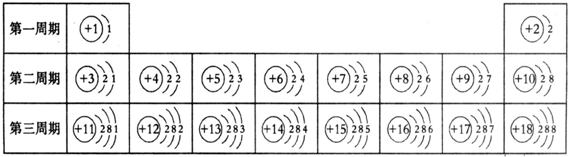
(1)原子序数为10的元素名称是
(填“活泼”或“不活泼”).
(2)镁原子的核电荷数是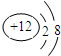
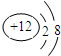 .
.
(3)某粒子的结构示意图为 ,若该粒子为原子,则X与Y的关系式为
,若该粒子为原子,则X与Y的关系式为
(4)从11到17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:
.(任写一条)
查看习题详情和答案>>

(1)原子序数为10的元素名称是
氖
氖
,在化学反应中,该元素的化学性质不活泼
不活泼
(填“活泼”或“不活泼”).
(2)镁原子的核电荷数是
12
12
,在化学反应中易失去
失去
电子而形成Mg2+
Mg2+
(填离子符号),该离子结构示意图是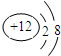
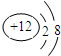
(3)某粒子的结构示意图为
 ,若该粒子为原子,则X与Y的关系式为
,若该粒子为原子,则X与Y的关系式为x=10+y
x=10+y
;若X=17,Y=8,则该粒子的符号为Cl-
Cl-
.(4)从11到17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:
最外层电子数逐渐递增
最外层电子数逐渐递增
.(任写一条)
已知一个碳-12 原子的质量为1.993x10-26kg,一个A原子的质量为5.146x10-26kg,若A原子核内中子数比质子数多1,则
(1)A原子的相对原子质量为
查看习题详情和答案>>
(1)A原子的相对原子质量为
31
31
(取整数).(2)A原子的核外电子总数为15
15
.
我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是 ;
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法 ;
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量 ;
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应 (填“吸热”或“放热”)同时还可以观察到固体粉末发生变化的现象是 ;
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在 mL处.(不考虑实验带来的误差)
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称 ;
ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度 (填“偏大”或“偏小”).
iii鼓入空气的目的是 ,装置A中试剂X应选用 ;
ivE装置的作用是 ;
(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
i从上表数据判断, 秒时,已经反应完全;
ii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.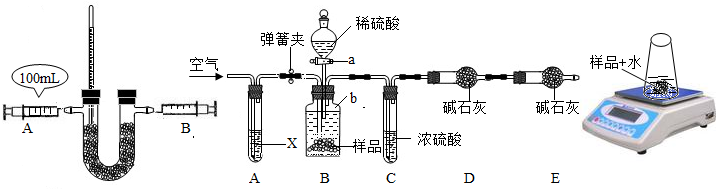 查看习题详情和答案>>
查看习题详情和答案>>
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称
ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度
iii鼓入空气的目的是
ivE装置的作用是
(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
| 时间/s | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
ii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.
 查看习题详情和答案>>
查看习题详情和答案>>
(2010?杨浦区一模)在实验室配制l0%的氢氧化钠溶液、5%的盐酸、10%的盐酸三种溶液.
(1)写出氢氧化钠溶液与盐酸反应的化学方程式
(2)若忘记了给的三瓶配制溶液的贴上标签,想对未贴标签的三瓶溶液进行鉴别.现只提供无色酚酞试液、试管和胶头滴管,请你用简便的方法鉴别出三种溶液,并完成下列实验报告.
查看习题详情和答案>>
(1)写出氢氧化钠溶液与盐酸反应的化学方程式
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
,(2)若忘记了给的三瓶配制溶液的贴上标签,想对未贴标签的三瓶溶液进行鉴别.现只提供无色酚酞试液、试管和胶头滴管,请你用简便的方法鉴别出三种溶液,并完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
1、分别取三种少量的溶液于试管中,滴加无色酚酞溶液, 2、分别取步骤1检验出的氢氧化钠溶液于两支试管中,分别滴入无色酚酞, 1、分别取三种少量的溶液于试管中,滴加无色酚酞溶液, 2、分别取步骤1检验出的氢氧化钠溶液于两支试管中,分别滴入无色酚酞, |
溶液变红色, 再用胶头滴管逐滴滴入步骤一没有变色的两种溶液至溶液变为无色,观察两种溶液滴加的数量 溶液变红色, 再用胶头滴管逐滴滴入步骤一没有变色的两种溶液至溶液变为无色,观察两种溶液滴加的数量 |
则是氢氧化钠溶液, 加的滴数少则是5%的盐酸,多的则是10%的盐酸 则是氢氧化钠溶液, 加的滴数少则是5%的盐酸,多的则是10%的盐酸 |