摘要:1.(2010·山西师大附中1月考题)中国网通集团在原有EAC网络的基础上.建造了一条 约350公里长的海底光缆.在2008年北京奥运会中担当重要通信任务.下列关于通 信光缆成分的说法中不正确的是 ( ) A.光导纤维的主要成分为SiO2 B.硅为亲氧元素.在自然界中都以化合态形式存在 C.SiO2熔点高.硬度大.其结构中最小的环为12元环 D.科学家提出硅将作为21世纪一种普遍使用的新型能源被开发利用.寻找高效催化剂使SiO2分解同时释放能量.是硅能源大规模利用的关键 解析:硅发生氧化反应生成SiO2要放出大量的热.则SiO2分解需要吸收大量的热.催化剂不能改变反应热.所以D项说法错误.C项中.由于金刚石的最小碳环为6元环.用硅原子代替金刚石中的碳原子.在每个硅原子间再“插入 一个氧原子.所以SiO2晶体中最小环是12元环. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_81646[举报]
中国石油天然气集团在四川发现了中国最大的天然气田,预计储量达7000亿立方米。天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关的说法不正确的是
[ ]
A.甲烷与丙烷互为同系物
B.甲烷不能使高锰酸钾酸性溶液褪色
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
查看习题详情和答案>>
B.甲烷不能使高锰酸钾酸性溶液褪色
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
中国石油天然气集团在四川发现了中国最大的天然气田,预计储量达7000亿立方米。天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关的说法错误的是
[ ]
A.甲烷与丙烷互为同系物
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
查看习题详情和答案>>
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
(2012?奉贤区二模)为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
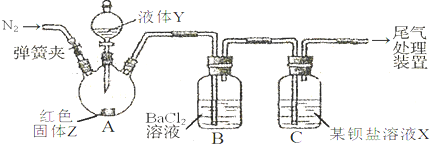
实验操作和现象:
(1)A中反应的化学方程式是
(2)C中可溶性钡盐溶液X为
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是
甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是
(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体.C中反应的化学方程式是
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体.C中沉淀为
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是
查看习题详情和答案>>

实验操作和现象:
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量液体Y,加强热; | A中有白雾生成,红色固体Z的表面产生气泡.B中有气泡冒出,产生大量白色沉淀.C中产生白色沉淀,液面上方略显红棕色并逐渐消失. |
| 打开弹簧夹,通入气体N2,停止加热,一段时间后关闭; | |
| 从B、C中分别取少量白色沉淀,加稀盐酸. | 均未发现白色沉淀溶解 |
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(2)C中可溶性钡盐溶液X为
硝酸钡
硝酸钡
.实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:将分液漏斗改为恒压漏斗
将分液漏斗改为恒压漏斗
.(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是
空气参与了反应
空气参与了反应
,乙同学认为是白雾参与反应.为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间.乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D.甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是
空气、白雾均是产生白色沉淀的原因,白雾是主要原因
空气、白雾均是产生白色沉淀的原因,白雾是主要原因
.| 甲 | 大量不溶于稀盐酸的白色沉定 |
| 乙 | 少量不溶于稀盐酸的白色沉淀 |
3SO2+2H2O+3Ba(NO3)2═3BaSO4↓+2NO↑+4HNO3
3SO2+2H2O+3Ba(NO3)2═3BaSO4↓+2NO↑+4HNO3
.(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体.C中沉淀为
BaSO3、氢氧化铝
BaSO3、氢氧化铝
.实验室里欲获得该沉淀,所需要的玻璃仪器是烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
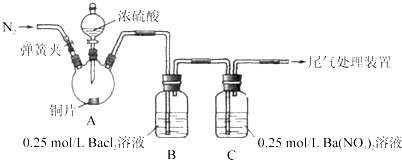
实验操作和现象:(BaCl2提示:A中产生的白雾,是H2SO4的酸雾)
(1)A中反应的化学方程式是
(2)C中白色沉淀是
(3)C中液面上方生成浅棕色气体的化学方程式是
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是
乙在A、B间增加洗气瓶D,D中盛放的试剂是足量饱和NaHSO3溶液.其目的是
②甲、乙分别进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释白色沉淀产生原因:
甲:
(5)合并(4)中两同学的方案进行试验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是
查看习题详情和答案>>

实验操作和现象:(BaCl2提示:A中产生的白雾,是H2SO4的酸雾)
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(2)C中白色沉淀是
BaSO4
BaSO4
,该沉淀的生成表明SO2具有还原
还原
性.(3)C中液面上方生成浅棕色气体的化学方程式是
2NO+O2=2NO2
2NO+O2=2NO2
.(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是
通N2一段时间,排除装置的空气
通N2一段时间,排除装置的空气
;乙在A、B间增加洗气瓶D,D中盛放的试剂是足量饱和NaHSO3溶液.其目的是
吸收H2SO4酸雾
吸收H2SO4酸雾
.②甲、乙分别进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
甲:
SO42-+Ba2+=BaSO4↓
SO42-+Ba2+=BaSO4↓
;乙:2Ba2++2SO2+O2+2H2O=2BaSO4+4H+
2Ba2++2SO2+O2+2H2O=2BaSO4+4H+
.(5)合并(4)中两同学的方案进行试验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
.