网址:http://m.1010jiajiao.com/timu3_id_81460[举报]
1994年10月12日,瑞典皇家科学院宣布授予美国南加利福尼亚大学有机化学家乔治?安德鲁?欧拉(George?Andrew?Olah)教授1994年度诺贝尔化学奖,以表彰他在碳正离子化学研究方面所作的贡献。
(1)1962年,欧拉和他的同事们把(CH3)3CF溶于过量的SbF5介质中,获得理想的结果,它们之间反应的化学方程式是 ,SbF5属于 类化合物,其理由是 。
(2)欧拉对碳正离子的贡献不仅在于实验方面,更重要的是他在1972年提出系统的碳正离子新概念。CH3+、CH5+两类碳正离子的结构中,中心碳原子分别采取 、_____杂化方式。试分别画出它们的结构式。
(3)在(C6H5)3C+碳正离子中,除了σ键外,还存在 键,它可表示为 ,形成此种键型的条件是 。
查看习题详情和答案>> 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)臭氧与氧气的关系是
(2)选出下列分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有
(4)O3分子是否为极性分子
(5)O3与O2间的转化是否为氧化还原反应
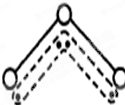 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V形,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V形,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)选出下列分子与O3分子的结构最相似的是
A H2O B CO2 C SO2 D BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤电子对,那么O3分子有
(3)O3与O2间的转化是否为氧化还原反应
A O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
B O3在催化剂作用下生成1molO2转移电子数
(8分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。臭氧分子的结构如图,呈V型,两个O-O键的夹角为116.5º,三个原子以一个O原子为中心,与另外两个氧原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学健―三个O原子均等地享有这4个电子。(如右图所示)。请回答: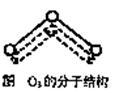
(1)臭氧与氧气的关系是______________。
(2)选出下列分子与O3分子的结构最相似的是( )
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(4)O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
_____PbS + _____O3 ——_____PbSO4 + _____O2; 查看习题详情和答案>>
(5分) 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图5,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:

图5 O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子与O3分子的结构最相似的的是 。
A. H2O B. CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有______对孤对电子。
(4)O3分子是否为极性分子___________(是或否)。
(5)O3与O2间的转化是否为氧化还原反应___________
查看习题详情和答案>>