摘要:如图为某同学设计的验证质量为25 g的银元完全溶解于一定量的硝酸后生成NO2气体中含有NO的实验装置图.并测定银元中银的质量分数.已知:常温时.NO2与N2O4同时存在,在低于0℃时.几乎只有无色的N2O4的晶体存在. (1)反应前先打开A中的活塞K1.持续通一段时间N2.其理由是 . (2)若装置中缺B.其后果是 . (3)反应结束后.打开D中的活塞K2.并通入氧气.银铜合金完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为: . 化学反应方程式为 . (4)C装置的作用是 , E中a仪器所起的作用是 . (5)若该同学将A中完全反应后的溶液倒入烧杯--通过生成AgCl沉淀的方法确定该银元中银的质量分数.其实验方案和操作为: . 解析:该实验的目的是证明生成物中有NO的存在.生成的NO2降温后转化成N2O4晶体.无色NO与O2反应生成红棕色的NO2.验证NO的存在.浓硫酸吸水.防止NO2与H2O反应生成NO干扰实验. 答案:(1)排除装置内的空气.防止NO被空气中的O2氧化 (2)在C中水蒸气被冷却成液态水.它与NO2或N2O4反应生成NO.干扰NO的验证 (3)D瓶内气体由无色变成红棕色 2NO+O2===2NO2 (4)把NO2全部转化为N2O4晶体.避免在D装置中对NO的验证产生干扰 防止倒吸 (5)用蒸馏水洗涤烧瓶2-3次.洗液也倒入烧杯中.然后加入过量的NaCl溶液.过滤.洗涤.烘干.称量AgCl的质量.计算Ag的质量及质量分数
网址:http://m.1010jiajiao.com/timu3_id_81444[举报]
(2010?济南一模)下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
(4)I元素在周期表里的位置在第
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
查看习题详情和答案>>
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
氮
氮
(写出元素名称),请设计一个简单的实验证明这一结论取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
.或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(4)I元素在周期表里的位置在第
三
三
周期、第VIIA
VIIA
族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
13
13
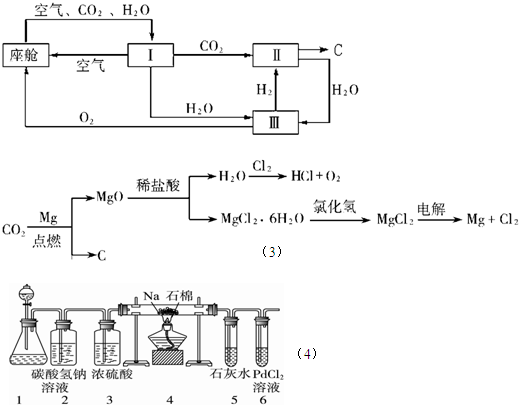
.(KW=1.00×10-14)(2010?平顶山模拟)航天飞行器座舱内空气更新过程如下图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O
(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②
(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
查看习题详情和答案>>
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
2H2+CO2=2H2O+C
2H2+CO2=2H2O+C
.(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O
10
10
mol.(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②
生成的Mg和Cl2可以循环利用
生成的Mg和Cl2可以循环利用
.(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
2Na+2CO2=Na2CO3+CO
2Na+2CO2=Na2CO3+CO
.②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
4Na+3CO2=2Na2CO3+C
4Na+3CO2=2Na2CO3+C
.③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
将4中固体加足量水,有不溶黑色固体,则生成物中有C
将4中固体加足量水,有不溶黑色固体,则生成物中有C
.