网址:http://m.1010jiajiao.com/timu3_id_81422[举报]
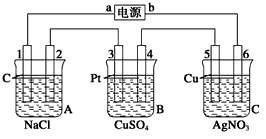
(12分)如下图,通电5 min后,电极5质量增加2.16 g ,回答:
(1) 电源:a是________极;A池中电极 上产生气体能使湿润KI淀粉试纸变蓝;B池中电极 上发生氧化反应,电解过程中pH (填增大、减小或不变)。
电池电极反应,电极1: ;电极4: 。
A池电池总反应 。
C池电池总反应 。
(2) 如果B池中共收集到224 mL气体(标准状况) ,且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为 。
查看习题详情和答案>>
(12分)如下图,通电5 min后,电极5质量增加2.16 g,回答:
(1)电源:a是________极,b是________极;A池电极反应,电极1:__________;
电极2:____________________________________________________________。
C池电极反应,电极5:________________________________________________;
电极6:______________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
(12分)如下图,通电5 min后,电极5质量增加2.16 g,回答:
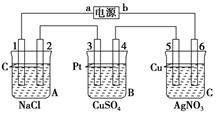
(1)电源:a是________极,b是________极;A池电极反应,电极1:__________;
电极2:____________________________________________________________。
C池电极反应,电极5:________________________________________________;
电极6:______________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
查看习题详情和答案>>