网址:http://m.1010jiajiao.com/timu3_id_81365[举报]
已知某种燃料含有碳、氢、氧3种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)

|
|
实验前 |
实验后 |
|
(干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
|
(石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水质量为________g,假设广口瓶里生成一种正盐,其质量为________g;
(2)生成的水中氢元素的质量为________g;
(3)生成的二氧化碳中碳元素的质量为________g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
查看习题详情和答案>>
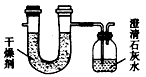

(1)实验完毕后,生成物中水的质量为__________g,假设广口瓶里生成1种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为______________g。
(3)生成的CO2中碳元素的质量为____________g。
(4)该燃料中碳、氢元素质量比为____________。
(5)已知这种燃料的每个分子中只有1个氧原子,则该燃料的分子式为________,结构简式为__________。
| 实验前 | 实验后 |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
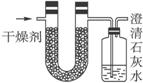
根据实验数据求:
(1)实验完毕后,生成物中水的质量为_________g。假设广口瓶里生成一种正盐,其质量为_________g。
(2)该燃料中碳元素与氢元素的质量比为_________。
(3)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_________,结构简式为_________。
查看习题详情和答案>>|
|
实验前 |
实验后 |
|
(干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
|
(石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |

根据实验数据求:
(1)实验完毕后,生成物中水的质量为_________g。假设广口瓶里生成一种正盐,其质量为_________g。
(2)该燃料中碳元素与氢元素的质量比为_________。
(3)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_________,结构简式为_________。
查看习题详情和答案>>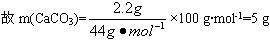
| 实验前 | 实验后 |
(干燥剂+U形管)的质量 | ||
(石灰水+广口瓶)的质量 |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为_______________g,假设广口瓶里生成一种正盐,其质量为_______________ g。
(2)生成的水中氢元素的质量为_______________ g。
(3)生成的二氧化碳中碳元素的质量为_______________ g。
(4)该燃料中碳元素与氢元素的质量比为_______________。
(5)已知这种燃料的每个分子中只能含有一个氧原子,则该燃料的分子式为______________,结构简式为_______________。
查看习题详情和答案>>